
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是
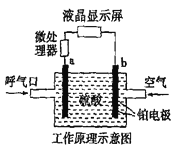
A. b为正极,电极反应式为:O2+4H++4e-=2H2O
B. 电解质溶液中的H+移向a电极
C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
D. 呼出气体中酒精含量越高,微处理器中通过的电流越小
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行究. 以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成). 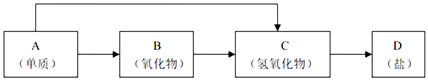
(1)A与水反应的离子方程式: .
(2)若B为呼吸面具中的供养剂,其供养时每生成1mol O2 , 反应过程中转移的电子数为 .
(3)200℃时,11.6g CO2和 H2O 的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为 .
(4)写出一种“C→D”转化的离子方程式: .
(5)某同学将一小块A单质露置于空气中,观察到下列现象:
银白色 ![]() 变灰暗
变灰暗 ![]() 变白色
变白色 ![]() 出现液滴
出现液滴 ![]() 白色固体
白色固体
则下列说法正确的是
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对原子结构与性质的说法中,正确的一项是
A.ns电子的能量不一定高于(n-1)p电子的能量
B.基态原子3p轨道上只有2个未成对电子的元素是S或Si
C.LiOH是一种易溶于水、受热不易分解的强碱
D.电离能大的元素,其原子不易失电子而易得电子,表现出非金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时水的离子积Kw=1×10-12。这时将等体积硫酸和氢氧化钠溶液混合,若溶液混合后显中性,则混合前硫酸的pH和氢氧化钠溶液的pH之和为( )
A.12B.14C.13D.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(普通)化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向方向)
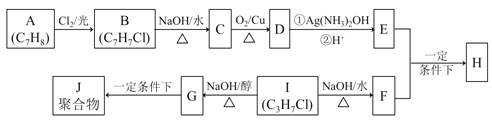
已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称 ,B的结构简式 。
(2)B → C和G → J两步的反应类型 , 。
(3)① E + F → H的化学方程式 。
② I → G 的化学方程式 。
(4)I的同系物K比I相对分子质量大28,K有多种同分异构体。
①K的同分异构体共 种。
②若K不能发生消去反应,则K的结构简式为_________ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图的转化关系,下列说法正确的是( )
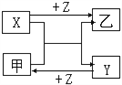
A. X、Y、Z一定是非金属单质
B. 若X、Y都为金属单质,则Z必为非金属单质
C. X、Y、Z中至少有一种是金属单质
D. 如果X、Y都为非金属单质,则Z必为金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于一些重要的化学概念,下列叙述正确的是
A.根据丁达尔现象可以将分散系分为溶液、胶体和浊液
B.CO2、NO2、Mn2O7、P2O5 均为酸性氧化物
C.漂白粉、水玻璃、铝热剂均为混合物
D.熔融状态下,CH3COOH、NaOH、MgCl2 均能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶金厂的矿渣含有较多的Al2O3、Fe2O3、MgO、SiO2,现欲进行综合利用以提取氧化铝、氧化镁、氧化铁作为工业原料,其设计的工艺流程如下:
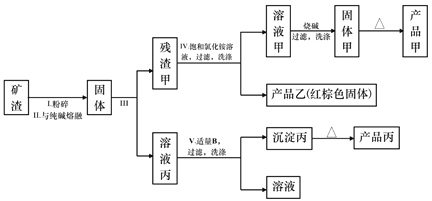
已知:
①硅酸的酸性比氢氧化铝强。
②饱和氯化铵溶液的pH约为5。
③氢氧化镁开始沉淀至沉淀完全的pH范围:9.0~12.0。
④氢氧化铁开始沉淀至沉淀完全的pH 范围:2.7~4.0。
回答下列问题:
(1)写出过程II中发生反应的化学方程式:_______________、_____________________。
(2)过程Ⅲ的名称是_______________;产品乙的俗名是_________________。
(3)过程V中所用适量的B是一种常见气体,过程V中所发生的反应的离子方程式为_______。
(4)残渣甲用饱和氯化铵溶液能部分溶解的原因是_______________(用离子方程式表示)。
(5)解释工业上不用电解产品甲制备相应金属单质的原因________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com