
下列离子方程式正确的是( )
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2===NO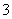 +NO↑+H2O
+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应:2HCO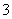 +Ca2++2OH-===CaCO3↓+CO
+Ca2++2OH-===CaCO3↓+CO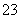 +2H2O
+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应:2MnO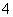 +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO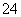 +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
科目:高中化学 来源: 题型:
A、B的结构简式如下:
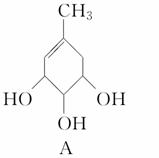
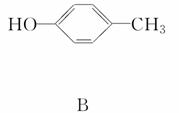
(1)A分子中含有的官能团的名称是______________;
B分子中含有的官能团的名称是____________。
(2)A能否与氢氧化钠溶液反应____________;
B能否与氢氧化钠溶液反应____________。
(3)A在浓硫酸作用下加热可得到B,其反应类型是____________________。
(4)A、B各1 mol分别加入足量溴水,完全反应后消耗单质溴的物质的量分别是________mol,________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子。则下列关于三氯化氮的叙述正确的是
A.N元素的非金属性比Cl元素强
B.在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl
C.在NCl3分子中N为—3价,NCl3跟水发生水解反应的产物是NH3和HClO
D.NCl3跟水反应生成NH4Cl、O2和Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.萃取操作时,选择有机萃取剂,则溶质在萃取剂的溶解度必须比水大
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球插入混合溶液的液面下
D.配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
关于Li、Na、K、Rb、Cs的叙述均正确的一组是 ( )
①金属性最强的是铯 ②它们的氧化物都只有M20和M202两种形式
③在自然界中均以化合态形式存在 ④密度按Li—Cs顺序依次递增
⑤离子半径:Rb+>K+>Na+
A.①②③ B.①③④⑤ C.②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol?L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol?L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol?L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I. 取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III. 向2 mL 0.1 mol?L-1 FeCl3溶液中滴加2滴0.1 mol?L-1 KSCN溶液,变红,通入O2,无明显变化。
① 实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① mol?L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | ③ | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1 mol?L-1 FeCl3溶液 | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
参照反应Br+H2  HBr+H的能量对反应历程的示意图。
HBr+H的能量对反应历程的示意图。
下列叙述正确的是
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热变大
C.反应物总能量低于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率

查看答案和解析>>
科目:高中化学 来源: 题型:
在2L密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:
2X(g)+ 2Y(g) 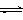 Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2 W(g) △H<0, 反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
A.5s内平均反应速率为υ(Y)= 0.2 mol/( L·s)
B.该反应的平衡常数数值为0.5
C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率
D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在学习了乙酸的性质后,根据甲酸的结构(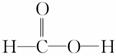 )对甲酸的化学性质进行了下列推断,其中不正确的是
)对甲酸的化学性质进行了下列推断,其中不正确的是
( )
A.能与碳酸钠溶液反应
B.能发生银镜反应
C.不能使KMnO4酸性溶液褪色
D.能与单质镁反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com