
【题目】下列是有关实验现象与分析或结论都正确的是( )
实验现象 | 分析或结论 | |
A | 光照新制氯水有气泡冒出 | 氯水含有Cl2,光照Cl2逸出 |
B | 液氯滴到干燥的有色布条会褪色 | 液氯中的次氯酸具有漂白性 |
C | 往NaHCO3固体加入新制氯水,有无色无味的气体产生 | 氯水中含有盐酸与NaHCO3反应,产生CO2 |
D | 新制氯水放置数天后,pH值将增大 | 氯化氢具有挥发性,酸性减弱 |
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO=CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。则原混合气体中甲烷物质的量是 mol。求原混合气体中二氧化碳可能的体积 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去乙烷中混有的少量乙烯,应采用的简便方法是( )
A. 将混合气体通过氢氧化钠溶液
B. 使混合气体中的乙烯发生加聚反应
C. 将混合气体在催化剂条件下跟氢气反应
D. 将混合气体通过溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H>0,如图表示反应II在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,则图中t2时刻发生改变的条件可能是 。
CO(g)+H2O(g) △H>0,如图表示反应II在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,则图中t2时刻发生改变的条件可能是 。
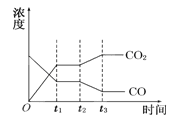
A升高温度 B降低温度 C加入催化剂 D增大压强
E减小压强 F充入CO2 G分离出部分CO
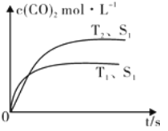
(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H<0
2CO2(g)+N2(g) △H<0
在恒容密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:
反应I:CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
①下表所列数据是反映I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1 (填“>”“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,请用三段式计算平衡常数并计算此时的温度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实、事件、事故中与甲烷有无关的是
A. 天然气的主要成分 B. 石油经过催化裂化及裂解后的产物
C. “西气东输”中气体 D. 煤矿中的瓦斯爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH-
B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C.将过量SO2通入氨水中:SO2+NH3·H2O=HSO3-+NH4+
D. Ba(OH)2溶液中加入NaHSO4溶液至沉淀完全:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2+ 4OH-![]() 2CO32-+6H2O,则下列说法正确的是
2CO32-+6H2O,则下列说法正确的是
A. 构成该电池的正极和负极必须是两种活性不同的金属
B. 充电时有CH3OH生成的电极为阳极
C. 放电时电解质溶液的pH逐渐增大
D. 放电时负极的电极反应为:CH3OH-6e-+8OH-= CO32-+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的Mg与100mL2mol/L的盐酸充分反应(假设反应后溶液的体积不变)。计算(要求:写出计算过程)
(1)该盐酸中HCl的物质的量;
(2)参加反应的Mg的物质的量;
(3)生成H2的体积(标准状况);
(4)充分反应后,溶质的物质的量浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com