
 某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.
某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.

科目:高中化学 来源: 题型:
| A、向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氢氧化钡溶液与硫酸氢钠溶液1:1混合Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
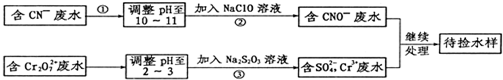
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应物分子必须碰撞才有可能发生反应 |
| B、发生有效碰撞的分子具有最高的能量 |
| C、有效碰撞是活化分子在一定方向上的碰撞 |
| D、活化分子的平均能量称之活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
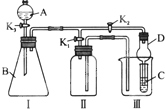 某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组的同学共同设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
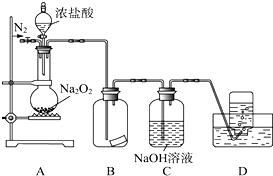 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下:
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下: Na2O2+
Na2O2+ HCl═
HCl═ Cl2+
Cl2+ NaCl+
NaCl+
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com