
| A�� | 10ml��������Ϊ98%��H2SO4����10mlˮϡ�ͺ�H2SO4��������������49% | |
| B�� | ����0.1mol/L��Na2CO3��Һ480mL������500mL����ƿ | |
| C�� | �Ʊ�Fe��OH��3����ʱ��������FeCl3��Һ�����ˮ�У����ȱ߽��裬ֱ���õ����ɫ��Һ | |
| D�� | ��2�ȷݲ����͵��ռ���Һ�зֱ����һ������Na2O2����Na2O��ʹ��Һ��ǡ�ñ��ͣ�������Na2O2��Na2O�����ʵ���֮�ȵ���1��1�������¶Ȳ��䣩 |
���� A��Ũ������ܶȦ�1����ˮ���ܶȦ�2��Ũ��Խ���ܶ�Խ��
B��ʵ����û��480mL������ƿ��Ӧ��500mL������ƿ�������ƣ�
C���Ʊ����壬���ܽ��裻
D��������Ӧ��2Na2O2+2H2O�T4NaOH+O2����Na2O+H2O�T2NaOH���ɷ���ʽ��֪����ͬ���ʵ�����Na2O2��Na2O��������ͬ���ʵ�����ˮ��������ͬ���ʵ�����NaOH�������¶Ȳ��䣬ʹ��Һǡ�ñ��ͣ��ʼ����Na2O2��Na2O�����ʵ�����ȣ�
��� �⣺A��Ũ������ܶȦ�1����ˮ���ܶȦ�2����ˮ��Ũ������������=$\frac{10mL����{\;}_{1}��98%}{10mL����{\;}_{1}+10mL����{\;}_{2}}$��100%=$\frac{1}{1+\frac{��{\;}_{2}}{��{\;}_{1}}}$��49%����A��ȷ��
B��ʵ����û��480mL������ƿ��Ӧ��500mL������ƿ�������ƣ�����n=cV��m=nM���м��㣬��B��ȷ��
C���Ʊ�Fe��OH��3����ʱ�������͵�FeCl3��Һ�����ˮ�У�����ֱ���õ����ɫ��Һ�����ܽ��裬��C����
D����Ҫ����80���������������ƣ���Ҫ78�������Ĺ������ƣ�ͬʱ����18��������ˮ����Ҫ62�������������ƣ�ͬʱ����18��������ˮ��������Na2O2��Na2O�����ʵ���֮�ȵ���1��1����D��ȷ��
��ѡC��
���� ���⿼����ҺŨ�ȼ��㡢����������ע�������������ʵ���Ũ������������֮��Ĺ�ϵ��ע��ʵ���ҳ�������ƿ�Ĺ����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ò�˿պȡ����ij��Һ������ɫ��Ӧ������ʻ�ɫ������Һ��һ������K+ | |
| B�� | ��Һ©��������ƿ��ʹ��ǰ��Ҫ��© | |
| C�� | ��ij��Һ�м���ϡ���ᣬ������������ʹ����ʯ��ˮ����ǣ�����Һһ����̼������Һ | |
| D�� | 0.84g����50.00 mL 1.00 mol/L��ϡ���ᷴӦ����Ӧ����Һ��һ��ֻ��Fe3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
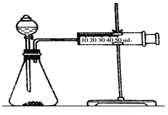 Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ij������ȤС����ʵ��ķ�������̽����
Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ij������ȤС����ʵ��ķ�������̽����| ʵ�鲽�� | ���� | ���� |
| �ٷֱ�ȡ�������2mol/L���������Թ��У��ڷֱ�Ͷ���С����״��ͬ��Al��Fe��Mg | ��Ӧ������Mg��Al��Fe | ��Ӧ�������Խ���ã���Ӧ����Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������з���NaCl��Һ�����ȡ������õ�NaCl���� | |
| B�� | ��10 mL����Ͳ��ȡ4.8 mL������ | |
| C�� | ��������ƽ��ȡ25.20 g NaCl | |
| D�� | ��1000 mL����ƿ����450 mL 0.1 mol•L-1������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ��� | �¶� | KI��Һ | H2SO4��Һ | ������Һ | ʵ��Ŀ�� | ||
| C��KI�� | V | C��H2SO4�� | V | ||||
| 1 | 25�� | 1mol/L | 5mL | 0.1mol/L | 5mL | 3�� | l���2��̽�����¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻2���3��̽����Ӧ��Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�� |
| 2 | 35�� | 1mol/L | 5mL | 0.1mol/L | 5mL | 3�� | |
| 3 | 35�� | 1mol/L | 5mL | ��0.2mol/L���� | 5mL | 3�� | |
| ʵ�鷽�� | Ԥ��ʵ����������� |
| ȡ������ˮ���Թ��У����뼸�ε�����Һ��Ȼ����μ���1mol/L KOH��Һ���۲����� | ����ɫ����ɫ����������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ĵ���ʽ�� | B�� | CCl4���ӵı���ģ�ͣ� | ||
| C�� | ��ϩ�붡��ϩ�����ʽ��ͬ | D�� | 2-�������Ľṹ��ʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
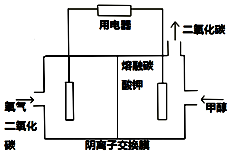 �״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϣ���ҵ�ϳ�����CO���Ʊ��״���
�״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϣ���ҵ�ϳ�����CO���Ʊ��״���| ������� | �������/L | �¶�/K | CO���ʵ���/mol | H2���ʵ���/mol | CH3OH���ʵ���/mol | ƽ��ʱCOŨ��/mol•L-1 | ƽ�ⳣ��K |
| 1 | 1.0 | 500 | 0.2 | 0.2 | 0 | 0.12 | K1 |
| 2 | 1.0 | 800 | 0.1 | 0 | 0.1 | 0.16 | K2 |
| 3 | 2.0 | 800 | 0.2 | 0.2 | 0 | X | K3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com