
分析 (1)根据氯离子物质的量计算ACl2的物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,进而计算A的相对原子质量,确定A的元素符号,书写化学式;
(2)摩尔质量以g/mol为单位,数值上等于其相对原子质量;1个原子质量=$\frac{摩尔质量}{阿伏伽德罗常数}$;
(3)根据n=$\frac{m}{M}$=$\frac{V}{Vm}$以及结合分子的组成计算;
(4)结合n=$\frac{V}{Vm}$、c=$\frac{n}{V}$及配制溶液前后溶质的物质的量不变来计算.
解答 解:(1)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的物质的量为$\frac{0.4mol}{2}$=0.2mol,ACl2的摩尔质量是$\frac{19g}{0.2mol}$=95 g•mol-1,则A的相对原子质量为95-35.5×2=24;
故答案为:95 g•mol-1;24;
(2)铝的相对原子质量为27,则其摩尔质量为27g/mol,若阿伏加德罗常数为NA,则可估算一个铝原子的质量约为$\frac{27g/mol}{{N}_{A}mo{l}^{-1}}$=$\frac{27}{{N}_{A}}$g,
故答案为:27g/mol;$\frac{27}{{N}_{A}}$;
(3)0.5mol CH4的质量是m=nM=0.5mol×16g/mol=8g;其体积为V=nVm=0.5mol×22.4L/mol=11.2L;含有H原子的物质的量为0.5mol×4=2mol,则H原子个数为2NA;
故答案为:8;11.2;2NA;
(4)标准状况下22.4L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为$\frac{\frac{22.4L}{22.4L/mol}}{0.2L}$=5mol/L;
配制溶液前后溶质的物质的量不变,则配制300mL0.5mol•L-1氯化钠溶液,需要1.5mol•L-1的氯化钠溶液的体积为$\frac{0.3L×0.5mol/L}{1.5mol/L}$=0.1L=100mL,
故答案为:5mol/L;100.
点评 本题考查物质的量有关计算,把握物质的量、浓度、体积之间的关系及配制溶液的计算等为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | H+,CO32-,Cl-,Na+ | B. | Al3+,NH4+,OH-,NO3- | ||
| C. | Ag+,Br-,SO42-,K+ | D. | NO3-,Na+,H+,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
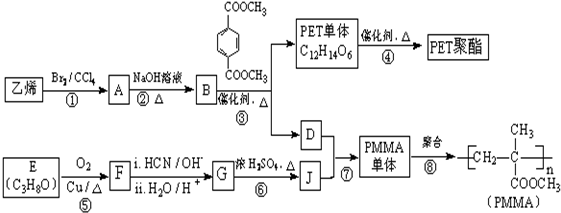
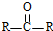 $→_{H_{2}O/H+}^{i.HCN/OH-}$
$→_{H_{2}O/H+}^{i.HCN/OH-}$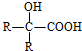 (R、R′代表烃基)
(R、R′代表烃基)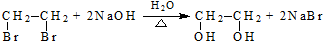
 .
.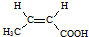 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
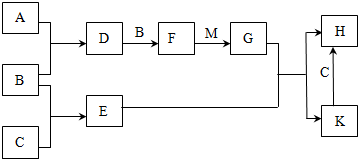
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
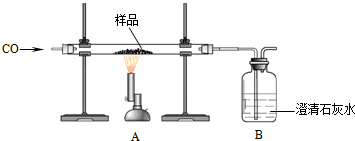
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.50g | 反应前55.56g | 反应前281.00g |
| 反应后55.08g | 反应后281.25g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
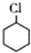 (一氯环己烷)$→_{II}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{II}^{NaOH,乙醇,△}$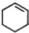 $→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$
$→_{Ⅲ}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{Ⅳ}{→}$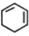

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com