
| A. | 分别将它们配制成溶液,再加入澄清石灰水 | |
| B. | 分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸 | |
| C. | 分别将它们配制成溶液,再加入CaCl2溶液 | |
| D. | 分别加热,再用石灰水检验是否有CO2产生 |
分析 A.均反应生成白色沉淀;
B.逐滴加入等浓度的稀盐酸,碳酸氢钠溶液中有气体生成,碳酸钠溶液中开始无气体生成,随加入盐酸增多,后来生成气体;
C.碳酸钠与氯化钙反应生成碳酸钙沉淀,碳酸氢钠与氯化钙不反应;
D.依据碳酸氢钠、的稳定性不同解答.
解答 解:A.均反应生成白色沉淀,现象相同,无法鉴别,故A错误;
B.逐滴加入等浓度的稀盐酸,碳酸氢钠溶液中有气体生成,碳酸钠溶液中开始无气体生成,随加入盐酸增多,后来生成气体,现象不同,可以鉴别,故B正确;
C.碳酸钠与氯化钙反应生成碳酸钙沉淀,碳酸氢钠与氯化钙不反应,现象不同,可以鉴别,故C正确;
D.分别加热,再用石灰水检测是否有CO2产生,碳酸氢钠受热分解生成二氧化碳气体,碳酸钠不分解,现象不同,可以鉴别,故D正确;
故选:A.
点评 本题考查Na2CO3和NaHCO3溶液的鉴别,为高频考点,熟悉二者的性质差别是解题关键,注意对基础知识的积累.


科目:高中化学 来源: 题型:解答题
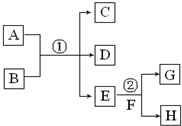 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的OH-向负极移动 | |
| B. | 在银表面上的反应为:Ag2S+2e-═2Ag+S2- | |
| C. | 在铝表面的反应为:Al-3e-═Al3+ | |
| D. | 在铝表面的反应为:Al+4OH--3e-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
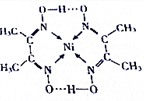 从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:
从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变是指在恒压、恒温下,体系不做体积功,只做其它功的变化过程的热效应 | |
| B. | 书写热化学方程式时若不标明温度和压强,则表示是在0℃、101kpa条件下的反应热 | |
| C. | 化学反应中的能量变化,是由化学反应中化学键断裂时吸收的能量与生成物中化学键形成时放出的能量不同所导致的 | |
| D. | 吸热反应的△H<0,放热反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
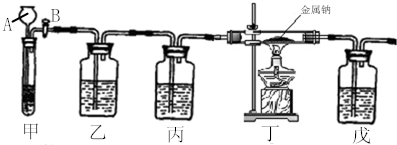
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 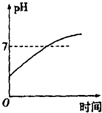 | B. | 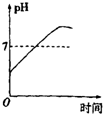 | C. | 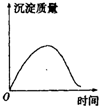 | D. | 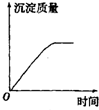 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
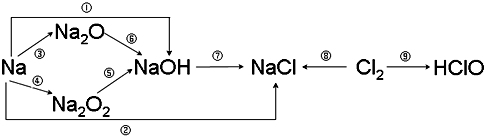
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1mol H-H键和1 mol I-I键所需能量大于断开2mol H-I键所需能量 | |
| C. | 断开2mol H-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2akJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com