
分析 CaO为碱性氧化物,能够与酸反应生成盐和水,与酸性氧化物反应生成盐,与水反应生成氢氧化钙等;金属氧化物一般能够与酸反应生成盐和水,活泼金属的氧化物与水反应生成对应碱,能够与酸性氧化物反应生成盐等,据此进行解答.
解答 解:CaO为典型的碱性氧化物,能够与水反应生成氢氧化钙:CaO+H2O=Ca(OH)2,也能够与酸性氧化物(如二氧化碳)反应生成盐:CaO+CO2=CaCO3,还能够与酸反应生成盐和水,如与盐酸反应生成氯化钙和水,反应方程式为:CaO=2HCl=CaCl2+H2O;
通常金属氧化物为碱性氧化物,能够与酸反应生成盐和水,活泼金属的氧化物与水反应生成对应碱,还可以与酸性氧化物反应生成盐等,
故答案为:CaO+H2O=Ca(OH)2、CaO+CO2=CaCO3、CaO=2HCl=CaCl2+H2O等;与酸反应生成盐和水,活泼金属的氧化物与水反应生成对应碱,还可以与酸性氧化物反应生成盐等.
点评 本题考查了金属氧化物性质,题目难度不大,明确氧化钙的化学性质为解答关键,注意掌握常见金属氧化物通性,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 18g冰中最多含有氢键的数目为4NA | |
| B. | 0.1L3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| C. | 7.8gNa2O2中阴、阳离子总数为0.4NA | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na3PO4═3Na++P5++4O2- | B. | H2SO4═H++SO42- | ||
| C. | NH3•H2O?NH4++O2-+H+ | D. | NH4NO3═NH4++NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将1molCH3COONa溶于水,向其中加入醋酸至溶液pH=7,此溶液中CH3COO-的数目约为6.02×1023 | |
| B. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-CH3COONa溶液与0.1mol•L-HCl溶液等体积混合:c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| D. | 10mL0.1mol•L-1醋酸溶液与20mL0.1mol•L-NaOH溶液混合:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3:4 | B. | 1:3:1 | C. | 7:5:9 | D. | 7:5:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
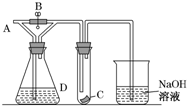 如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )
如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | 浓盐酸 | D. | 饱和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com