
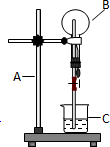
 如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液
如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液分析 (1)依据仪器形状说出气名称;
(2)氯化氢极易溶于水,氯化氢溶于水得到盐酸,盐酸具有酸性据此解答;
(3)工业上用在氯气中点燃氢气的方法制备氯化氢.
解答 解:(1)依据常见仪器的形状可知,装置中A、B、C三仪器的名称分别为:A铁架台;B圆底烧瓶;C烧杯;
故答案为:铁架台;圆底烧瓶;烧杯;
(2)氯化氢极易溶于水,氯化氢溶于水得到盐酸,盐酸具有酸性,能够使紫色石蕊试液变红色,所以当打开弹簧夹,并挤压预先盛水的胶头滴管后,可以看到产生红色喷泉;
故答案为:产生红色喷泉;
(3)氢气在氯气中燃烧生成氯化氢,方程式:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,
故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
点评 本题考查了氯化氢的工业制备性质,明确制备原理及喷泉实验原理、氯化氢的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 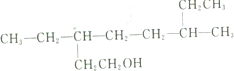 的名称为3,6-二乙基-1-庚醇 的名称为3,6-二乙基-1-庚醇 | B. | 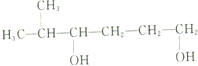 的名称为2-甲基-3,6-己二醇 的名称为2-甲基-3,6-己二醇 | ||
| C. | 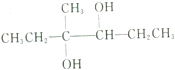 的名称为4-甲基-2,4-己二醇 的名称为4-甲基-2,4-己二醇 | D. | 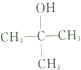 的名称为2-甲基-2-丙醇 的名称为2-甲基-2-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
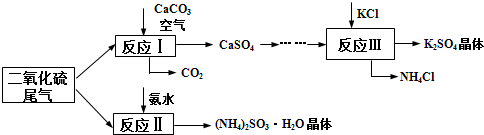
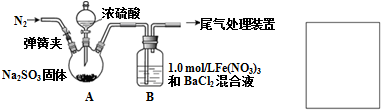
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元 素 | Mn | Fe | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-=BaSO⒋↓ | |
| B. | 稀硫酸中加入铜片:Cu+2H+=Cu2++H2↑ | |
| C. | 氧化铜溶于盐酸:O2-+2H+=H2O | |
| D. | 二氧化碳通入足量澄清石灰水:Ca2++2OHˉ+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com