
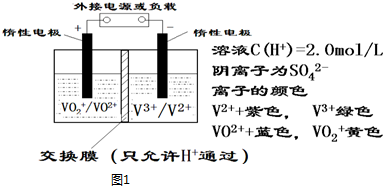
分析 ①左槽溶液逐渐由黄变蓝,VO2+转变为VO2+,发生还原反应,应为原电池的正极,
②充电过程中,右槽连接电源的负极,发生还原反应,为电解池的阴极,电极反应式为V3++e-=V2+,
③充电时,左槽发生的反应为VO2++H2O-e-=VO2++2H+当转移电子为3.01×1023个即为0.5 mol电子时,生成氢离子为0.5 mol;
(1)电镀铜时铜为阳极,连接电源的正极;
(2)Al2(SO4)3水解呈酸性,离子放电顺序为H+>Al3+>Na+,Cl->OH->SO42-,阳极依次发生:2Cl--2e-═Cl2↑,4OH--4e-═O2↑+2H2O;阴极发生2H++2e-=H2↑,结合相关离子的物质的量解答该题;
(3)判断电解池中Fe的阴阳极,然后分析其工作原理;
(4)C为电极时生成氯气,Fe为阳极时生成亚铁离子,亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氯气成氢氧化铁,结合氢氧化铁具有吸附性分析对污水的影响.
解答 解:①当左槽溶液逐渐由黄变蓝,其电极反应式为VO2++2H++e-=VO2++H2O,说明此时为原电池,且为原电池的正极,
故答案为:VO2++2H++e-=VO2++H2O;
②充电过程中,右槽连接的是电源负极,为电解池的阴极,电极反应式为V3++e-=V2+,V3+为绿色,V2+为紫色,
故可以看到右槽溶液颜色逐渐由绿色变为紫色.
故答案为:绿;紫;
③放电过程中,电极反应式为VO2++2H++e-=VO2++H2O,氢离子的作用是充电时,参与正极反应,通过交换膜定向移动使溶液成电中性;左槽发生的反应为VO2++H2O=VO2++2H++e-,当转移电子为3.01×1023个即为0.5 mol电子时,生成氢离子为0.5mol,则氢离子变化0.5mol,
故答案为:参与正极反应;通过交换膜定向移动使溶液成电中性;0.5mol;
(1)若负载是镀铜的电镀槽,则纯铜为阳极,应该连接电源的正极,即左槽,
故答案为:左;
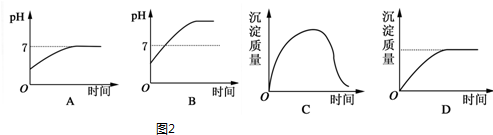
(2)假设混合溶液的体积为1L,
则n(Cl-)=0.3mol,n(Al3+)=0.1mol,
离子放电顺序为H+>Al3+>Na+,Cl->OH->SO42-,
阳极发生:2Cl--2e-═Cl2↑,Cl-离子全部放电,失去0.3mol电子,
阴极反应为2H++2e-═H2↑,得到0.3mol电子,生成0.3molOH-,
发生Al3++3OH-═Al(OH)3↓,
剩余溶液为K2SO4,溶液呈中性,pH=7,
继续电解,为电解水,溶液pH不变,沉淀不溶解,
所以图2电解变化的曲线合理的是AD,
故答案为:AD;
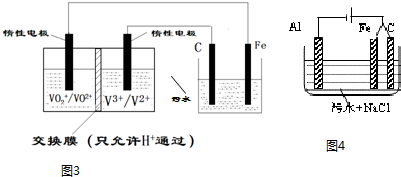
(3)铁电极连接原电池的正极,为电解池的阳极,则铁失去电子生成亚铁离子,亚铁离子将Cr2O72-还原为Cr3+,发生反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:阳极的金属铁放电得到的亚铁离子将Cr2O72-还原为Cr3+;
(4)根据图示可知,阳极为C时生成氯气,阳极为Fe时溶液中产生亚铁离子,亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁易被氯气氧化成氢氧化铁,氢氧化铁具有很强吸附性,可以净水,
故答案为:产生促使污物聚沉的Fe(OH)3.
点评 本题考查原电池和电解池的知识,较为综合,题目难度中等,做题时注意利用守恒的思考去解答,同时注意电极反应式的书写方法,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重.因此由PM2.5引起的雾霾一定属于气溶胶 | |
| B. | 纪录片中详细阐述了煤的大量燃烧是产生雾霾的主要原因,如果使用前对煤进行脱硫处理,可减少二氧化硫的排放;石膏法脱硫工艺是一种常用的脱硫技术 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物--光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物,原因是汽油燃烧不充分 | |
| D. | 多植树造林,使用“乙醇汽油”,改燃煤为燃气,外出时使用PM2.5的口罩等都是治理“雾霾”等灾害性天气的有效措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物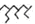 的名称为2,4 一二乙基-6-丙基辛烷 的名称为2,4 一二乙基-6-丙基辛烷 | |
| B. | 月桂烯 (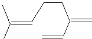 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液,苯酚钠溶液中出现白色浑浊,说明酸性:醋酸>碳酸>苯酚 | |
| D. | 在盛有试粉溶液的试管中加入70%的硫酸边搅拌边加热5分钟,冷却至室温,再加入氢氧化钠中和至碱性.加入银氨溶液水浴加热,产生银镜.说明淀粉水解能产生还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 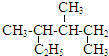 的系统命名是3,4-二甲基己烷 的系统命名是3,4-二甲基己烷 | |
| B. | 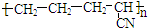 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 | |
| C. | 等质量的甲醛和乳酸[CH3CH(OH)COOH]完全燃烧消耗的氧气不相等,但生成水的质量相等 | |
| D. | 分析反应: ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
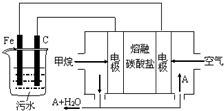 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
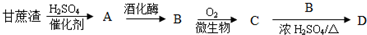
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com