
| A. | 石油是混合物 | |
| B. | 油脂是天然高分子化合物 | |
| C. | 铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀 | |
| D. | 氨气显碱性,可用浓硫酸干燥 |
分析 A.石油中含有煤油、柴油、汽油等很多物质;
B.高分子化合物的相对分子质量达到10000以上,油脂相对分子质量较小;
C.在海轮外壳装铜块,形成了Fe-Cu原电池,铁为负极,加快了铁的腐蚀;
D.氨气与硫酸反应,不能使用浓硫酸干燥.
解答 解:A.石油中含有煤油、柴油、汽油等很多物质,具有多种成分,属于混合物,故A正确;
B.油脂相对分子质量较小,不属于高分子化合物,故B错误;
C.铜、铁、海水组成原电池,铜的金属活动性比铁弱,铁做负极,被腐蚀,故在海轮外壳上装若干铜块会加快船体的腐蚀速率,故C错误;
D.氨气为碱性气体,不能使用浓硫酸干燥,可以用碱石灰干燥,故D错误;
故选A.
点评 本题考查了金属的腐蚀与防护、气体的干燥、高分子化合物的判断等知识,题目难度中等,明确原电池原理、气体的性质及干燥方法为的关键,注意掌握高分子化合物的概念,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物的水化物酸性减弱的顺序是HNO3、H3PO4、H3AsO4 | |
| B. | 气态氢化物的水溶液碱性增强的顺序是NH3、PH3、AsH3 | |
| C. | 随着核电荷数的增大,其原子半径减小 | |
| D. | 随原子序数增大,气态氢化物的稳定性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中P得到电子 | |
| B. | 消耗1mol KClO3时,转移5mol 电子 | |
| C. | 发令时看到白烟可能是P2O5固体颗粒 | |
| D. | 氧化剂与还原剂的物质的量比为6:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂是HCl,还原剂是MnO2 | |
| B. | 每生成2 mol Cl2,转移电子的物质的量是4 mol | |
| C. | 每消耗1 mol MnO2,表现还原作用的HCl为4 mol | |
| D. | Cl2既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为NA个 | |
| B. | 通常状况下,NA 个CO2分子的体积为22.4L | |
| C. | 常温常压下,40gNaOH含有的钠离子个数为NA个 | |
| D. | 物质的量浓度为0.5mol/L的BaCL2溶液中,含有氯离子个数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
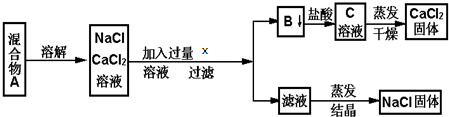
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:填空题
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题。
(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:
P4+CuSO4+H2O Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
(2)氮的化合物合成、应用及氮的固定一直是科学研究的热点。以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(3)右图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。

(4)常温下,向0.1mol/L氨水中加入少许N2O5,使溶液中c(NH3·H2O):c(NH4+)=5:9,此时溶液的pH= .(25℃时,NH3·H2O的电离常数Kb=1.8×10-5)
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%。请写出SiO2溶于氢氟酸的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com