



 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3 mol/L |
| B、4 mol/L |
| C、5 mol/L |
| D、6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 可逆反应:mA(g)+nB(g)═pC(g)+gD(g)的v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:
可逆反应:mA(g)+nB(g)═pC(g)+gD(g)的v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:| A、②④⑥⑧ | B、②④⑤⑦ |
| C、②③⑤⑦ | D、②③⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:
 正、负极都是碳材料的双碳性电池,电池充、放电过程为2nC+LiA
正、负极都是碳材料的双碳性电池,电池充、放电过程为2nC+LiA | 充电 |
| 放电 |
| A、a是电池的负极 |
| B、放电时,A-离子向b极移动 |
| C、放电时,负极的电极反应式是nC-e-+A-=CnA |
| D、充电时,电解质中的离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:
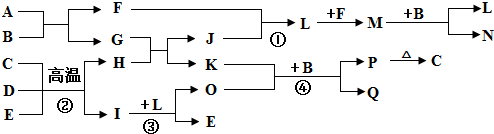
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com