
| A. | 原混合溶液中c(K+)为4 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
分析 电解硝酸钾和硝酸铜混合溶液时,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电生成铜单质,当铜离子完全析出时,氢离子放电生成氢气,根据得失电子守恒计算铜的物质的量,再结合电荷守恒计算钾离子的浓度,据此分析解答.
解答 解:电解硝酸钾和硝酸铜混合溶液时,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电生成铜单质,当铜离子完全析出时,氢离子放电生成氢气,气体的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol;
每生成1mol氧气转移4mol电子,每生成1mol氢气转移2mol电子,每生成1mol铜转移2mol电子,
所以根据转移电子守恒得铜的物质的量=$\frac{1mol×4-1mol×2}{2}$=1mol,
则铜离子的物质的量浓度=$\frac{1mol}{0.5L}$=2mol/L,
根据电荷守恒得钾离子浓度=6mol•L-1-2mol/L×2=2mol/L,
A.根据分析知,原混合溶液中c(K+)为2 mol•L-1,故A错误;
B.转移电子的物质的量=1mol×4=4mol,故B正确;
C.根据以上分析知,铜的物质的量为1mol,故C错误;
D.当电解硝酸铜时溶液中生成氢离子,当电解硝酸钾溶液时,实际上是电解水,所以电解后氢离子的物质的量为氧气的4倍,为1mol×4=4mol,则氢离子浓度=$\frac{4mol}{0.5L}$=8mol/L,故D错误;
故选:B.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,结合转移电子守恒、电荷守恒来分析解答,难度中等.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:多选题
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为$\frac{8x}{a}$ | D. | y g 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
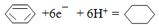 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
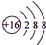 .
. .常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.
.常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.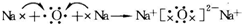 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②③ | C. | ②④ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显酸性,俗称石碳酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com