
【化学—选修3物质结构与性质】(15分)
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族。 E、F都是第四周期元素,
E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有
1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 。
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 。
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d= g/cm3。(保留两位小数)

(1)M(1分);9(1分) (2) (1分);1s22s22p63s23p63d104s1(1分)
(1分);1s22s22p63s23p63d104s1(1分)
(3)sp2(1分);四面体(1分); (4)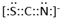 (2分)
(2分)
(5)3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;(2分) (6)CuFeS2 (2分) 4.32(3分)
【解析】
试题分析:已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C原子的基态电子排布中L能层都有两个未成对电子,则A是碳元素,C是氧元素,所以B是氮元素。C、D同主族,则D是S元素。 E、F都是第四周期元素,F原子除最外能层只有1个电子外,其余各能层均为全充满,这说明F是铜元素。E原子的基态电子排布中有4个未成对电子,则E的3d能级上含有6个电子,因此E是铁元素。
(1)S是第三周期元素,则基态S原子中,电子占据的最高能层符号M层,该能层含有s、p、d三个能级,则具有的原子轨道数为1+3+5=9个。
(2)铁的原子序数是26,则根据核外电子排布规律可知亚铁离子的价层电子排布图是 。铜的原子序数是29,则铜原子的电子排布式是1s22s22p63s23p63d104s1。
。铜的原子序数是29,则铜原子的电子排布式是1s22s22p63s23p63d104s1。
(3)A元素的最高价氧化物对应的水化物是碳酸,分子中碳元素价层电子对数是3个,且不存在孤对电子,所以中心原子采取的轨道杂化方式为sp2。B元素的气态氢化物NH3分子中氮元素有一对孤对电子,则价层电子对数是4,所以氨气的VSEPR模型为四面体。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,则根据CO2的电子式可推知DAB-的电子式为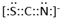 。
。
(5)配合物甲的焰色反应呈紫色,说明含有钾元素。其内界由中心离子Fe3+与配位体CN-构成,配位数为6,则甲的化学式为K3[Fe(CN)6]。甲的水溶液可以用于实验室中亚铁离子的定性检验,实验现象是产生蓝色沉淀,则检验Fe2+离子的离子方程为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓。
(6)故警报结构可知,铜原子的个数是8×1/8+4×1/2+1=4,铁原子数是6×1/2+4×1/4=4,硫原子全部位于晶胞中共计是8个,则其化学式为CuFeS2。晶胞的体积是(5.24×10—8cm)2×1.03×10—7cm,因此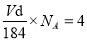 ,该晶体的密度d= 4.32g/cm3。
,该晶体的密度d= 4.32g/cm3。
考点:考查物质结构与性质模块的分析与应用


科目:高中化学 来源:2014-2015广东省增城市高一上学期期末化学试卷(解析版) 题型:选择题
下列与实验相关的叙述正确的是
A.金属钠着火时,可用泡沫灭火器灭火
B.蒸发结晶时应将溶液蒸干
C.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
D.在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液的颜色变化应该是
A.变棕黄色 B.变浅绿色 C.变棕红色 D.没有改变
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
某温度下,反应SO2(g)+  O2(g)
O2(g) SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应SO3(g) SO2(g) +
SO2(g) +  O2(g)的平衡常数K2的值为
O2(g)的平衡常数K2的值为
A.2500 B.100 C.0.02 D.0.001
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.温度过高对合成氨不利
D.常温下,将 1 mL PH = 3的醋酸溶液加水稀释至100mL,测得其PH<5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高三元月调考理综化学试卷(解析版) 题型:选择题
用酸性氢氧燃料电池(乙池)为电源进行电解的实验装置(甲池,一定条件下可实现有机物的电化学储氢)如下图所示。甲池中A为含苯的物质的量分数为10%的混合气体,B为10mol混合气体其中苯的物质的量分数为24%,C为标准状况下2.8mol气体(忽略水蒸汽),下列说法不正确的是

A.乙池中溶液的pH变大 B.E处通入H2,C处有O2放出
C.甲池中阴极区只有苯被还原 D.导线中共传导11.2mol电子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:实验题
(12分)某粗氧化铜样品中含少量氧化亚铁及不溶于酸的杂质,某化学兴趣小组利用该样品制取胆矾晶体,测定胆矾晶体中结晶水的含量,并计算样品中氧化铜的含量,设计了如下方案进行实验。

查阅资料知Fe3+、Cu2+、Fe2+在水溶液中形成氢氧化物沉淀的pH范围如下:

请回答下列问题:
(1)在整个实验过程中,下列仪器中不可能用到的是__________(填编号)。

(2)物质X应选用_________(填字母)。
a.氢氧化钠 b.双氧水 c.铁粉 d.高锰酸钾
(3)为保证沉淀Ⅱ沉淀完全,操作③中溶液pH的调节范围为 。
(4)操作④的步骤有 、冷却结晶、 、自然干燥。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行__ 次若测定结果x值偏大,可能的原因是_______________。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.加热胆矾晶体时有晶体从坩埚中溅出
(6)该小组一位同学根据实验结果求出样品中CuO的质量分数为 ,另一位同学不同意,其原因是 。
,另一位同学不同意,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:选择题
甲、乙、丙三种不同物质的转化关系:  则甲不可能是
则甲不可能是
A.Al2O3 B.SiO2 C.NH4Cl D.CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三上学期期末考试化学试卷(解析版) 题型:填空题
(9分)某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案:
实验序号 | 双氧水体积 | 双氧水浓度 | 添加的物质 | 待测数据X |
1 | 100mL | 20% | 无 | |
2 | 100mL | 20% | 10gMnO2 | |
3 | 100mL | 20% | 10gKI | |
4 | 100mL | 20% | 新鲜猪肝 |
(1)在该研究方案中,MnO2、KI和猪肝在双氧水分解的过程中可能起到 的作用。
(2)待测数据X为 。
(3)以下措施可以加快该实验中双氧水分解速率的是: (填标号)。
A.将双氧水的体积增大至200mL
B.将双氧水的浓度增大至30%
C.对装置A加热
D.上下移动B装置使量气管内气体压强增大
(4)从控制变量的原理来看,该方案是否合理 (填“是”或“否”)。理由是:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com