
【题目】已知有以下物质相互转化

试回答:
(1)写出B的化学式___________________,D的化学式_________________________。
(2)写出由E转变成F的化学方程式______________________________________。
(3)写出F转化成G的离子方程式________________________________________。
【答案】FeCl2 KCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe(OH)3+3H+=Fe3++3H2O
【解析】
根据D溶液与AgNO3溶液反应生成不溶于硝酸的白色沉淀H,因此H是AgCl,同时得到的溶液的焰色反应为紫色,说明D是KCl;根据白色沉淀E遇到空气变成红褐色沉淀F,可知E为Fe(OH)2,F为Fe(OH)3,G为FeCl3;根据B溶液和C溶液可以生成Fe(OH)2和KCl溶液,则B为FeCl2,C为KOH;A+G→B,A可以转化成B和气体,A为Fe;
(1)B的化学式为FeCl2,D的化学式为KCl。
(2)E转变为F的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)F转化为G的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O。


科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源,CH4—H2O催化重整是目前大规模制取氢气的重要方法。
(1)CH4-H2O催化重整:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1 = +210kJ/mol
CO(g)+3H2(g) H1 = +210kJ/mol
反应Ⅱ: CO(g)+ H2O(g)![]() CO2(g)+H2(g) H2 =﹣41kJ/mol
CO2(g)+H2(g) H2 =﹣41kJ/mol
①提高CH4平衡转化率的条件是________。
a.增大压强 b.加入催化剂 c.增大水蒸气浓度
②CH4、H2O催化重整生成CO2、H2的热化学方程式是________。
③在密闭容器中,将2.0 mol CO与8.0 mol H2O混合加热到800℃发生反应Ⅱ,达到平衡时CO的转化率是80%,其平衡常数为 _________。
(2)实验发现,其他条件不变,相同时间内,向催化重整体系中投入一定量的CaO可以明显提高H2的百分含量。做对比实验,结果如下图所示:

①投入CaO时,H2百分含量增大的原因是:_________。
②投入纳米CaO时,H2百分含量增大的原因是:__________。
(3)反应中催化剂活性会因积炭反应而降低,相关数据如下表:
反应 | Ⅰ | Ⅱ |
|
| |
H(kJ/mol) | +75 | ﹣173 |
①研究发现,如果反应Ⅰ不发生积炭过程,则反应Ⅱ也不会发生积炭过程。因此,若保持催化剂的活性,应采取的条件是_________。
②如果Ⅰ、Ⅱ均发生了积炭反应,通入过量水蒸气能有效清除积炭,反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过所学知识,回答下面问题
(1)写出铁与水蒸气在高温下反应方程式_______________________________________。
(2)加热碳酸氢钠的化学方程式为______________________________________
(3)在呼吸面具中,Na2O2起反应的化学方程式为__________________。当有7.8克Na2O2反应时,放出氧气的质量为__________。
(4)将铜片投入到FeCl3溶液中恰好完全反应,发生的反应离子方程式为___________。
(5)向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出此变化过程的化学方程式: __________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、氯、氮是三种常见的非金属元素。
完成下列填空:
(1)我们祖先的四大发明之一黑火药的爆炸反应为:S+2KNO3+3C A+N2↑+3CO2↑(已配平)。氮原子核外电子排布式为______________,生成物固体 A属于_____晶体。
(2)工业合成氨可以实现大规模固氮,氨可用于生产氯化铵、硫酸铵等化学肥料,等物质的量浓度的两溶液相同温度下pH大小为:氯化铵___________硫酸铵(选填>、=或<)。
(3)工业上在催化剂条件下,用NH3作为还原剂将烟气中的NO2还原成无害的氮气和水,反应方程式可表示为:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g),用单线桥标出该反应电子转移的方向和数目______,若该反应氧化产物比还原产物多0.1mol,被吸收的NO2在标准状况下的体积为_________。
7N2(g)+12H2O(g),用单线桥标出该反应电子转移的方向和数目______,若该反应氧化产物比还原产物多0.1mol,被吸收的NO2在标准状况下的体积为_________。
(4)氯水成分的多样性决定了其性质的复杂性,氯气可用作自来水生产过程中的消毒剂,写出其中主要的化学反应方程式______________________________,在硝酸银溶液中滴加氯水,可以看到有白色沉淀产生,起作用的微粒是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO(g)+2H2(g)CH3OH(g).反应的平衡常数如表:下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×102 | 2.4×104 | 1×105 |
A. 该反应的△H>0
B. 加压缩体积或增大CO浓度都能提高CO的转化率
C. 工业上采用高温高压的条件,目的都是提高原料气的转化率
D. t℃时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50%,则该反应温度在0-100℃之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:

下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)已知2A2(g)+B2(g)![]() 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
(1)比较a___b(填“>、=、<”)
(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
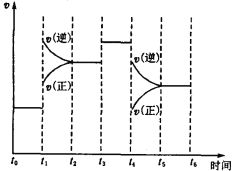
(3)下图表示此反应的反应速率v和时间t的关系图。根据下图判断,在t1和t4时刻改变的外界条件分别是_______________和 _____________ 。
(二)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
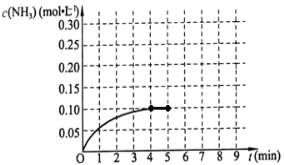
(1)根据上图,该反应达到平衡时H2的转化率等于__________。
(2)第5分钟末,保持其它条件不变,若改变反应温度,达新平衡后NH3的物质的量浓度不可能为_________。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1 c 0.10 mol·L-1 d 0.08 mol·L-1
(3)若在第5分钟末将容器的体积缩小一半后,在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟到9分钟NH3浓度的变化曲线。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取8.54 g含有Na2CO3、NaOH、Ba(NO3)2的固体混合物溶于足量水中,向反应后的试管中逐滴滴加1.00 mol·L-1的盐酸,加入盐酸的体积和沉淀质量的关系如图所示。

(1)混合物中Ba(NO3)2的物质的量至少为________mol。
(2)X的最大值为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,有人设计如下步骤:①将海带灼烧成灰,在灰中加水搅拌;②加四氯化碳充分振荡静置;③通入氯气;④过滤;⑤用分液法分离液体混合物。合理操作的先后顺序是
A. ①②③④⑤ B. ①④②③⑤
C. ①②④③⑤ D. ①④③②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com