
分析 (1)由于最终溶液中的溶质只有NaCl、NaClO,则n(Na+)=n(Cl-)+n(ClO-);
(2)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO),与H2反应的Cl2为n(Cl2)=$\frac{1}{2}$×[n(Cl-)-n(NaClO)],据此计算解答.
解答 解:(1)在反应后的溶液中Na元素的存在方式为NaCl、NaClO,根据Na、Cl元素守恒可得所得溶液中Cl-的物质的量为0.3mol-0.0500 mol=0.25mol,
故答案为:0.250mol;
(2)由方程式 NaOH+HCl=NaCl+H2O;Cl2+2NaOH=NaCl+NaClO+H2O.
可知与NaOH反应消耗的氯气的物质的量为0.0500 mol,
同时产生NaCl0.0500 mol.则HCl反应产生的NaCl的物质的量为0.25mol-0.0500 mol=0.20mol.
因此发生反应H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$2HCl的H2与Cl2的物质的量都为0.10mol.
所以n(H2)=0.1mol;n(Cl2)(总)=0.1mol+0.0500 mol=0.15mol,则所用氯气和参加反应的氯气的物质的量之比为:(0.1mol+0.05mol):0.1mol=3:2,
故答案为:3:2.
点评 本题考查了有关方程式的计算,难度中等,注意氢气与氯气反应后能被氢氧化钠完全吸收,氯气与氢气的体积之比等于或大于1:1即可,(1)注意利用守恒思想进行解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 四种元素中,丁元素的原子半径最小 | |
| B. | 气态氢化物的稳定性:乙>丙 | |
| C. | 同浓度的最高价含氧酸溶液的H+浓度丁>丙 | |
| D. | 元素甲和丙形成的两种常见化合物均为强还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a是一种非金属元素 | |
| B. | b与氧元素组成的氧化物一定是碱性氧化物 | |
| C. | c和d形成的化合物c2d2中各原子的最外层均达到8电子稳定结构 | |
| D. | b、c、d与氢元素形成的化合物中化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
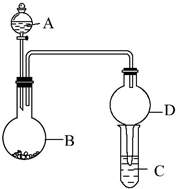 用如图所示装置进行实验(夹持装置已略去).请回答下列问题:
用如图所示装置进行实验(夹持装置已略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L溶液中K+浓度是0.4 mol•L-1 | |
| B. | 溶液中含有0.4NA个K+ | |
| C. | 1 L溶液中所含K+、SO42-总数为0.3NA | |
| D. | 2 L溶液中SO42-浓度是0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


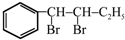



 与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为
与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为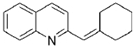 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com