

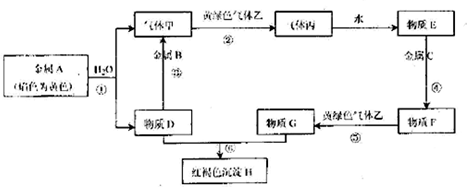
分析 依据元素化合价和物质分类分析,X为气态氢化物为H2S,Y为硫元素的+4价氧化物为SO2,Z为+4价的盐可以为Na2SO3,W为+6价的含氧酸为H2SO4;
(1)上述分析可知Y为二氧化硫气体;
(2)将X与Y混合,可生成淡黄色固体,是二氧化硫和硫化氢反应生成单质硫和水;
(3)将X的水溶液久置于空气中会变浑浊的反应是硫化氢和氧气反应生成硫单质和水;
(4)浓硫酸的三大特性:脱水性、吸水性和强氧化性,烧杯中加一些蔗糖,滴几滴水,浓硫酸使蔗糖脱水得到碳,碳和浓硫酸反应生成二氧化碳、二氧化硫和水蒸气,
(5)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2.
解答 解:X为气态氢化物为H2S,Y为硫元素的+4价氧化物为SO2,Z为+4价的盐可以为Na2SO3,W为+6价的含氧酸为H2SO4;
(1)上述分析可知Y为二氧化硫气体,故答案为:SO2;
(2)将X与Y混合,可生成淡黄色固体,是二氧化硫和硫化氢反应生成单质硫和水,反应的化学方程式为:2H2S+SO2=3S↓+2H2O,
故答案为:2H2S+SO2=3S↓+2H2O;
(3)将X的水溶液久置于空气中会变浑浊的反应是硫化氢和氧气反应生成硫单质和水,反应中H2S中硫元素化合价-2价变化为0价,具有还原性,
故答案为:还原;
(4)烧杯中加一些蔗糖,滴几滴水,浓硫酸使蔗糖脱水得到碳,碳和浓硫酸反应生成二氧化碳、二氧化硫和水蒸气,反应现象为:产生黑色海绵状固体,有酸雾,有刺激性气味,放出大量热,蔗糖变黑是浓硫酸的脱水性,生成气体是表现了浓硫酸的强氧化性,滴入水后反应表现了浓硫酸的吸水性,所以反应现象表现了浓硫酸的吸水性、脱水性、强氧化性,
故答案为:产生黑色海绵状固体,有酸雾,有刺激性气味,放出大量热,吸水性、脱水性、强氧化性;
(5)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,cd中S的化合价都大于2,b符合题意,
故答案为:b.
点评 本题考查非金属性比较、氧化还原反应、反应产物和反应现象等,侧重反应原理中高频考点的考查,注意根据氧化还原反应的规律解答,题目难度不大.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3加在BaCl2前 | B. | Na2CO3加在BaCl2后 | ||
| C. | 同时加 | D. | 无固定顺序 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
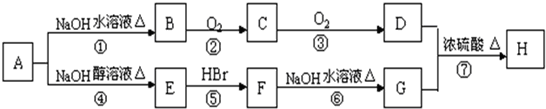
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸加入NaOH溶液至中性 H++OH-═H2O | 向H2SO4溶液加入Ba(OH)2溶液至中性 H++OH-═H2O |
| C | 向次氯酸钙溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | 向次氯酸钙溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洁厕灵的主要成分是盐酸,不能与“84”消毒液(主要成分是NaClO)混用 | |
| B. | 晶体的风化、煤的液化、石油的裂化都是化学变化 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
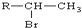 (R为烃基)
(R为烃基) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 钢铁吸氧腐蚀时,负极反应式为2H2O+O2+4e-═4OH- | |
| C. | 向醋酸钠溶液中加入适量醋酸至混合液pH=7时,溶液中c(Na+)=c(CH3COO-) | |
| D. | 0.1 mol/L NH4Cl溶液中,c(NH${\;}_{4}^{+}$)+c(H+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
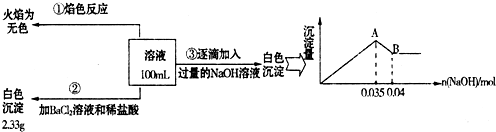
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com