
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
分析 ①加入浓氢氧化钠溶液,产生有刺激性气味的气体,应生成氨气,说明含有NH4+;②加氯水和淀粉无明显现象,说明不含I-,然后利用离子的共存及溶液呈电中性来分析还存在的离子和一定没有的离子,而对于不能确定的离子,则是还需检验的离子,以此解答该题.
解答 解:①加入浓氢氧化钠溶液,产生有刺激性气味的气体,应生成氨气,说明含有NH4+;②加氯水和淀粉无明显现象,说明不含I-,又溶液呈电中性,有阳离子必有阴离子,则溶液中有NH4+,必须同时存在阴离子,即SO42-必然存在,而Ba2+、SO42-能结合生成沉淀,则这两种离子不能共存,即一定不存在Ba2+;显然剩下的Na+是否存在无法判断,则需检验的离子是Na+.
故选A.
点评 本题考查离子的检验,为高频考点,侧重于学生的分析能力的考查,题目涉及确离子的共存、离子的检验、溶液呈电中性等知识,有助于训练学生解决问题时思维的严密性.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
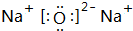 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
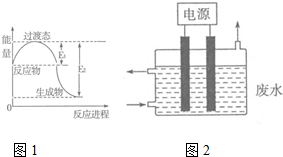 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
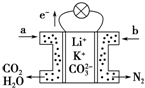 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )| A. | a为CH4,b为CO2 | |
| B. | CO32-向负极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 正极电极反应式为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
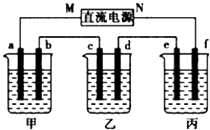 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
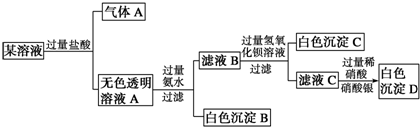
| A. | 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子 | |
| B. | 原溶液中是否存在Na+无法判断 | |
| C. | 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ | |
| D. | 生成沉淀B的离子方程式为:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.
(1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com