
| A. | 过渡元素全部是金属元素 | |
| B. | 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 | |
| C. | 催化剂一般在金属与非金属的分界线处寻找 | |
| D. | 同一主族元素的原子序数的差不可能为10 |
分析 A.过渡元素包含副族和第VIII族
B.根据周期表中第ⅡA族与第ⅢA族元素的位置;
C.催化剂一般在过渡元素处寻找;
D.H与Na的原子序数差为10.
解答 解:A.过渡元素包含副族和第VIII族,过渡元素全部是金属元素,故A正确;
B.同周期第ⅡA族与第ⅢA族元素的原子序数差值是1或11或25,不一定是1,故B错误;
C.催化剂一般在过渡元素处寻找,一般在金属与非金属的分界线处寻找半导体材料,故C错误;
D.H的原子序数为1,Na的原子序数为11,则H与Na的原子序数差为10,故D错误;
故选A.
点评 本题考查结构性质位置关系,比较基础,注意元素周期律的理解掌握,注意识记周期表中一些特殊性.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | Fe被氧化 | ||
| C. | CuSO4发生还原反应 | D. | 生成32g铜则转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
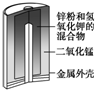 |  | 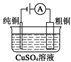 | 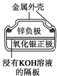 |
| 图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
| A. | 图Ⅰ所示电池中,MnO2的作用是催化剂 | |
| B. | 图Ⅱ所示电池充电过程中,阳极的反应为:PbSO4+2H2O+2e-═PbO2+SO42-+4H+ | |
| C. | 图Ⅲ所示装置工作过程中,若阳极质量减少6.4 g,则电路中转移电子数为0.2×6.02×1023 | |
| D. | 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 解释 | |
| A | 常温下,用pH计测定NaHCO3溶液的pH | pH=8.5 | HCO3-的水解程度大于电离程度 |
| B | 向一定量的浓硫酸中加入过量的锌粒,微热至反应结束 | 产生气泡 | 该气体为SO2 |
| C | 往盛有少量水的两支试管中分别加入Na和Na2O2 | 固体溶解,产生气泡 | 两个反应中水都作氧化剂 |
| D | 往盛有AlCl3溶液中滴加氨水至过量 | 产生白色沉淀,后溶解 | Al(OH)3具有两性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈酸性的雨水就是酸雨 | B. | “雷雨肥庄稼”符合科学道理 | ||
| C. | 光化学烟雾是由二氧化硫引起的 | D. | 臭氧层破坏与氮氧化物无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
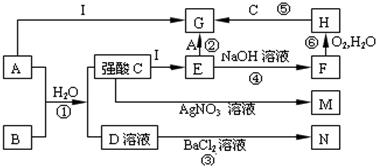
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
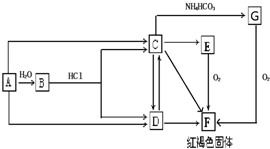
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com