
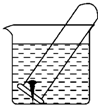
 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用.
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO3-、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克.常温下各烧杯中溶液的pH与电解时间t的关系如图所示.据此回答下列问题:
A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO3-、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克.常温下各烧杯中溶液的pH与电解时间t的关系如图所示.据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 |
| B、“血液透析”利用了胶体的性质 |
| C、“PM2.5”是细小颗粒物悬浮在空气中形成胶体,严重危害人体健康 |
| D、电解质在水溶液和熔融状态下均能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5 | B、6 | C、7 | D、8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉在空气中失效:2ClO-+CO2+H2O═2HClO+CO32- |
| B、碘化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- |
| C、硫酸铜溶液中滴加氢氧化钡溶液:Cu2++2OH-═Cu(OH)2↓ |
| D、将1mol/L偏铝酸钠溶液和1.5mol/L的盐酸等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com