
 NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
分析 I、(1)Cu与硝酸反应生成硝酸铜、NO和水,以此书写离子反应;
(2)①根据试验的目的是证明金属铜和硝酸之间的反应,根据目的选择所用的材料;
②图1中试管内有空气,NO被氧化为红棕色的气体;
(3)根据一氧化氮的溶解性与氧气的反应确定收集方法;
(4)根据得失电子守恒解答,1个铜原子失去2个电子,1个氧分子得到4个电子变成-2价的氧;
II.从经济角度出发,制取等量的硝酸铜时,所用的原料最少,成本最低;从环境保护的角度出发,制取硝酸铜时不对环境造成污染.
解答 解:I、(1)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮以及水,即3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,离子反应方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(2)①实验室若没有铜丝,铜粒以代替铜丝进行实验,则包裹桶里的不能是金属铁以及金属铝,因为他们的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应,
故答案为:C、D;
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮,即2NO+O2═2NO2,故答案为:2NO+O2═2NO2Ⅰ;
(3)由于一氧化氮与氧气在常温下反应生成二氧化氮,故不能用排空法收集,所以只能用排水法,故C正确,而D和E排水法收集装置,应该短进长出,所以D正确,E错误,故选:CD;
(5)铜和硝酸反应,铜失去电子,硝酸得到电子变成一氧化氮,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,一氧化氮和氧气和水反应生成硝酸,4NO+2H2O+3O2=4HNO3,氧气得电子,一氧化氮失去电子,所以铜失去的电子数等于氧气得到的电子数,12.8g Cu为 0.2mol,全部溶解,失去0.4mol电子,1个氧分子得到4个电子变成-2价的氧,所以需氧气0.1mol,0.1mol氧气在标准状况下的体积为2240mL,故答案为:2.24;
II.甲:铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,不环保,故甲不正确;
乙:铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,不环保,故乙不正确;
丙:此过程中使用到了氯气,氯气剧毒,对环保不利,且氯化铜不能与硝酸反应生成硝酸铜,故丙不正确;
丁:此过程用方程式可表示为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O,从过程可以看出该过程不会产生有毒气体,环保且没有多消耗原料,故丁正确;故答案为:丁.
点评 本题考查了铜与硝酸的反应,掌握相关的化学反应方程式是解答本题的关键,注意NO易被氧化及NO对环境的污染,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应2NO2═N2O4在室温下可自发进行,则该反应的△H<0 | |
| B. | 工业上电解熔融态氯化铝冶炼单质铝 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
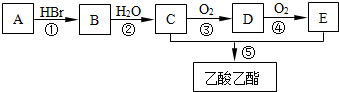

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
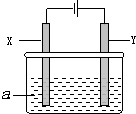
| 方案 | X | Y | a溶液 |
| A | 铁 | 银 | AgNO3 |
| B | 铁 | 银 | Fe(NO3)3 |
| C | 银 | 铁 | AgNO3 |
| D | 银 | 石墨 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不用稀硫酸,改用98%的浓硫酸 | B. | 加热 | ||
| C. | 适当增大稀硫酸的浓度 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烷 | ||
| C. | 混合气体中一定没有乙烷 | D. | 混合气体中一定没有乙炔(C2H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘-131原子核外有5个电子层 | |
| B. | 碘-131原子的最外层有7个电子 | |
| C. | 具有放射性的碘-131原子比普通碘-127原子多4个中子 | |
| D. | 131I2与127I2互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com