
【题目】常温下,下列有关电解质溶液叙述错误的是
A. 某H2SO4溶液中c(OH-)/c(H+)=1.0×10-8,由水电离出的c(H+)=1×10-11mol·L-1
B. 将0.02mol·L-1盐酸与0.02mol·L-1Ba(OH)2溶液等体积混合后溶液pH约为12
C. 将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH一定大于7
D. 向0.1mol·L-1Na2CO3溶液中逐滴滴加0.1mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
【答案】C
【解析】
A. 由水电离出的c(H+)等于由水电离出的c(OH-);
B.根据混合后得到的溶液中c(OH-)浓度来计算;
C. 将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH可能小于或等于7;
A项,由![]() =1.0×10-8,c(OH-)
=1.0×10-8,c(OH-)![]() c(H+)=1
c(H+)=1![]() 10-14可得c(OH-)=1×10-11mol·L-1,所以由水电离的c(H+)=1×10-11mol·L-1,故A项正确;
10-14可得c(OH-)=1×10-11mol·L-1,所以由水电离的c(H+)=1×10-11mol·L-1,故A项正确;
B项,假设体积均为1L,等体积混合后体积为2L,反应后剩余OH-的物质的量为0.02mol,得到c(OH-)=1×10-2mol·L-1,溶液pH约为12,故B项正确;
C项,将稀盐酸与稀氨水混合,随着盐酸量的增加,NH4Cl浓度增加,NH3·H2O浓度减小,溶液可以显酸性,中性或者碱性,故C项错误;
D项,向0.1mol·L-1Na2CO3溶液中逐滴滴加0.1mol·L-1稀盐酸,随着盐酸量的增大,先生成HCO3―,而后HCO3―与盐酸反应生成二氧化碳,故溶液中c(HCO3―)先增大后减小,故D项正确。
综上所述,本题正确答案为C。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
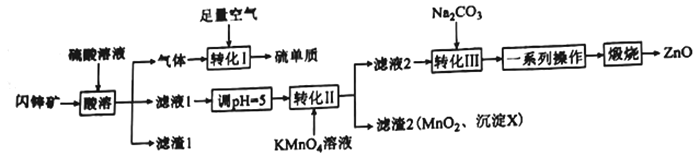
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:
请回答下列问题:
(1)滤渣1的化学式为____________________,任写一种该物质的用:______________________。
(2)沉淀X的化学式为_______________________________。
(3)“转化I”中氧化剂和还原剂的物质的量之比为________________________。
(4)“转化II”中主要反应的离子方程式为_____________________________________。
(5)若Ksp(ZnCO3)=1.5×10-10,溶液中离子浓度≤1.0×10-5 mol/L时,认为该离子沉淀完全。则欲使1 L c(Zn2+)=1.5 mol/L溶液中Zn2+沉淀完全,需加入等体积的Na2CO3溶液的物质的量浓度至少为____________________(列出计算式,溶液混合时体积变化忽略不计)。
(6)“一系列操作”包括过滤、洗涤、干燥。过滤所用的玻璃仪器有___________________________;洗涤沉淀的操作为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ/mol,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( )
A.温度B.压强C.焓变D.熵变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,利用如图所示装置探究元素非金属性强弱的变化规律。
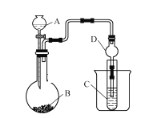
(1)仪器A的名称为_________,干燥管D的作用是_____。
(2)实验室中现有药品Na2S、浓盐酸、稀硫酸、MnO2,请选择合适药品设计实验探究氯和硫的非金属性强弱(必要时可以加热,图中省略):
①装置A中所装药品为_________。
②装置C中的实验现象为:有淡黄色沉淀生成,该装置中的化学反应方程式为__________。
③根据该实验探究出的结果,可知HCl的稳定性比H2S的稳定性____。(填“强”或“弱”)
(3)若要探究硫和碳元素的非金属性强弱,B、C中所装药品分别为Na2CO3固体、澄清石灰水,则A中反应的离子方程式为__________,观察到C装置中的现象为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.几种金属离子沉淀的pH:
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)加入过量硫酸之前先要将铬铁矿矿石粉碎,其目的是________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式_____________。
写出该反应的离子方程式_____________。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
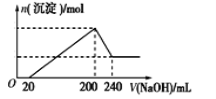
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含铁化合物的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物A、B、C、D有如下转化关系.回答下列问题:
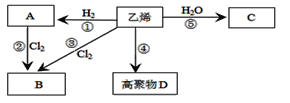
写出反应的化学方程式和有机反应类型:
②________,反应类型:______、⑤_____,反应类型:___。
(2)某化合物的结构简式为: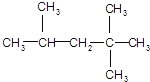 ,它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为________;
,它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:________________________________。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:___________________________________。
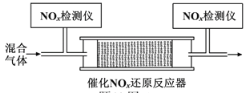
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见下图)。
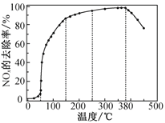
反应相同时间NOx的去除率随反应温度的变化曲线如题下图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com