
【题目】下列属于油脂的用途的是( )
①人类的营养物质 ②制取肥皂 ③制取甘油 ④制取高级脂肪酸 ⑤制取汽油
A. ①②③ B. ①③⑤ C. ②③④⑤ D. ①②③④
科目:高中化学 来源: 题型:
【题目】海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河人海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和________________池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:_______________________ (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通人到阴极室中,理由是_____________________。
②A口排出的是__________________(填“淡水”或“浓水”)。
(3)用苦卤(含 Na+、K+、Mg2+ Cl-、Br-等离子)可提取溴,其生产流程如下: 
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为:____________________.
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液?______________。
③向蒸馏塔中通人水蒸气加热,控制温度在90°C左右进行蒸馏的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种生命元素,组成某些蛋白质时离不开它。SO2是硫的一种重要氧化物,为探究SO2的性质,某化学兴趣小组的同学进行如下系列实验:
(1)将SO2通入紫色石蕊试液,现象是_________________。
(2)将SO2通入FeCl3溶液中,使其充分反应。写出SO2与FeCl3反应的离子方程式___________________;为了验证SO2与FeCl3发生了氧化还原反应,将反应后的溶液分成两份,并设计如下实验:
方案1:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去;
方案2:往第二份试液中加入KSCN溶液,不变红,再加入新制氯水,溶液变红。
上述方案合理的是__________。(填“方案1”或“方案2”或“均合理”)
(3)将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀。为探究该白色沉淀的成分,他们设计了如下实验流程:

操作①的名称为_____,试剂A为_______:加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是_______(填化学式)。
(4)为探究SO2的漂白是SO2直接作用于有色物质还是SO2与水反应的产物的作用。设计如图装置进行探究。
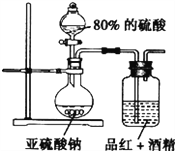
(信息提示:品红能溶解在酒精中形成红色溶液;H2SO3是二元弱酸)
①亚硫酸钠和浓硫酸反应的化学方程式为__________。
②请指出设计的装置中两个明显的不足:
___________________;________________________。
③按照修改后的装置,实验中控制SO2以较缓慢的速率通过品红的酒精溶液,60分钟后溶液仍不褪色,由此可推断,引起品红褪色的微粒可能是______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别食盐水和蔗糖水的方法有:①在两种溶液中分别加入少量稀硫酸,加热,再加入碱中和硫酸,再加入银氨溶液,微热;②测量溶液的导电性;③将溶液与溴水混合、振荡;④观察溶液颜色。其中在实验室进行鉴别的正确方法是
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下五种物质:A.![]() B.Ca(ClO)2 C.NO2 D.SiO2 E.淀粉,请根据题意,选择恰当的选项用字母代号填空。
B.Ca(ClO)2 C.NO2 D.SiO2 E.淀粉,请根据题意,选择恰当的选项用字母代号填空。
(1)漂白粉的有效成分是__________;
(2)通常状况下呈红棕色的是__________;
(3)光纤制品的基本原料是__________;
(4)通常状况下带有特殊气味、不溶于水的液体是__________;
(5)在常温下,遇碘变蓝的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2004年的诺贝尔化学奖授予以色列科学家阿龙·切哈诺夫、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们发现了泛素调节蛋白质水解。关于蛋白质的组成与性质的叙述正确的是
A. 蛋白质在酶的作用下水解的最终产物为氨基酸
B. 向蛋白质溶液中加入Na2SO4浓溶液,会使其变性
C. 天然蛋白质仅由碳、氢、氧、氮四种元素组成
D. 氨基酸和蛋白质都是只能和碱反应的酸性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用。
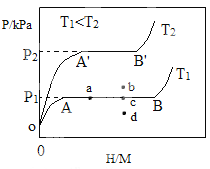
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MH与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)![]() zMHy(s) △H1(I);B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。
zMHy(s) △H1(I);B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。
反应(I)的焓变△HⅠ_______0(填“>”“<”或“=”)。
反应(I)中z=___________(用含x和y的代数式表示)。
温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=________mLg1min1。
(2)当反应(I)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(I)可能处于图中的_______点(填“b”“c”或“d”),该贮氢合金可通过______或_______的方式释放氢气。η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)___ _______η(T2)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。
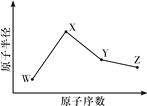
(1)X位于元素周期表中的位置是____________________。
(2)Z的气态氢化物和溴化氢相比,较稳定的是____________(写化学式)。
(3)W与X形成的一种化合物和水反应能生成W的单质,请写出该反应的化学方程式:________________________________________________________________________。
(4)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验能够获得成功的是( )
A. 只用溴水为试剂, 可以将苯、乙醇、己烯、四氯化碳四种液体区分开来。
B. 将无水乙醇加热到 170℃时, 可以制得乙烯
C. 苯酚和福尔马林在沸水浴中加热可以制取酚醛树脂
D. 乙醇、冰醋酸和 2 mol/L 的硫酸混合物, 加热可以制备乙酸乙酯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com