
(12分)
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为: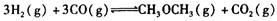
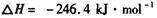
它可以分为两步,反应分别如下: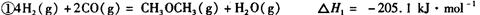
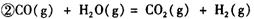
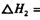 :__________________ ______________
:__________________ ______________
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速和CO的转化率的是_______(填字母代号)。
a.降低温度 b.加人催化剂 c.缩小容器体积
d.增加H2的浓度 e.增加CO的浓度
(3)在一体积可变的密闭容器中充入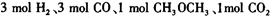 ,在一定温度和压强下发生反应:
,在一定温度和压强下发生反应: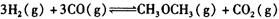 ,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率
,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率 的大小:V(正)____V(逆)(填“ >”、“ < ”或"="),理由是:________________________________
的大小:V(正)____V(逆)(填“ >”、“ < ”或"="),理由是:________________________________
②平衡时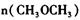 =_________________,平衡时CO的转化率= _________________。
=_________________,平衡时CO的转化率= _________________。
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:阅读理解
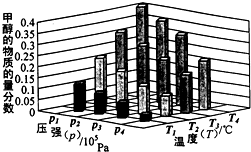 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省成都市六校协作体高二下学期期中联考化学试卷(带解析) 题型:填空题
(12分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
③CO(g)+H2O(g) CO2(g)+ H2(g) ⊿H3
CO2(g)+ H2(g) ⊿H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的 和
和 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中 的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中
的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中 的转化率随时间变化的图像。
的转化率随时间变化的图像。
(3)反应③中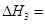 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是 (填代号)。
a. (正)
(正) (逆) b.
(逆) b. (正)<
(正)< (逆) c.
(逆) c. (正)=
(正)= (逆) d.无法判断
(逆) d.无法判断
(4)800K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g)  2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO3(g);△H=-96.56 kJ?mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
【1】达到平衡时,平衡常数K (甲) K (乙) K(丙)(填“>”、“<”或“=”)。
【2】达到平衡时SO2的浓度C(SO2)(甲) C(SO2) (乙) C(SO2) (丙)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:四川省模拟题 题型:填空题
 CH3OH(g);△H=-90.7 kJ/mol;
CH3OH(g);△H=-90.7 kJ/mol;  CH3OCH3(g) +H2O(g);△H= -23.5 kJ/mol;
CH3OCH3(g) +H2O(g);△H= -23.5 kJ/mol;  CO2(g)+H2(g);△H=-41.2kJ/mol。
CO2(g)+H2(g);△H=-41.2kJ/mol。 CH3OCH3(g) +CO2(g),则该反应的△H=____________
CH3OCH3(g) +CO2(g),则该反应的△H=____________  CH3OCH3(g) +3H2O(g);
CH3OCH3(g) +3H2O(g);
 SiHCl3(l)+ H2(g);
SiHCl3(l)+ H2(g); Si(纯) +3HCl。
Si(纯) +3HCl。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)
二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:
![]()
![]()
它可以分为两步,反应分别如下:
![]()
![]()
![]() :
:
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速和CO的转化率的是_______(填字母代号)。
a.降低温度 b.加人催化剂 c.缩小容器体积
d.增加H2的浓度 e.增加CO的浓度
(3)在一体积可变的密闭容器中充入![]() ,在一定温度和压强下发生反应:
,在一定温度和压强下发生反应:![]() ,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率的大小:V(正)____V(逆)(填“ >”、“ < ”或"="),理由是:________________________________
,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率的大小:V(正)____V(逆)(填“ >”、“ < ”或"="),理由是:________________________________
②平衡时![]() =_________________,平衡时CO的转化率= _________________。
=_________________,平衡时CO的转化率= _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com