
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 大理石与醋酸:CaCO3+2H+=Ca2++H2O+CO2 | |
| C. | 碳酸氢钙溶液中加入石灰水:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O | |
| D. | 明矾溶于水:Al3++3H2O?Al(OH)3+3H+ |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.醋酸为弱电解质,离子方程式中醋酸应该保留分子式;
C.钙离子足量,反应产物中不会有剩余的碳酸根离子;
D.明矾在溶液中电离出铝离子,铝离子水解生成的氢氧化铝胶体能够净水.
解答 解:A.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.碳酸钙和醋酸都需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.碳酸氢钙溶液中加入石灰水,反应生成的碳酸根离子完全转化成碳酸钙沉淀,正确的离子方程式为:Ca2++HCO3-+OH-=CaCO3+H2O,故C错误;
D.明矾的净水原理为:Al3++3H2O?Al(OH)3+3H+,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径:A<B<D<C | |
| B. | D元素处于元素周期表中第3周期第ⅥA族 | |
| C. | B、D的最高价氧化物中,B、D与氧原子之间均为双键 | |
| D. | 一定条件下,D单质能置换出B单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 氢氟酸 | C. | 烧碱 | D. | 饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
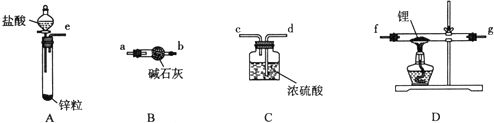
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
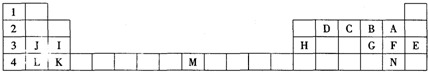
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com