
| A. |  =KCl+3Cl2↑+3H2O =KCl+3Cl2↑+3H2O | |
| B. | H2S+H2SO4(浓)═S↓+SO2↑+2H2O | |
| C. | 2H2S+SO2═3S↓+2H2O中氧化剂与还原剂的物质的量之比是1:2 | |
| D. | 3NO2+H2O═2HNO3+NO中氧化剂与还原剂的物质的量之比是1:1 |
分析 A.该反应中KClO3中元素Cl的化合价由+5价降低到0价,HCl中元素Cl的化合价由-1价升高到0价;
B.浓硫酸具有强氧化性将硫化氢氧化成S单质,本身被还原成二氧化硫;
C.在SO2+2H2S=2H2O+3S↓反应中,SO2中S元素的化合价由+4降低为0,H2S中S元素的化合价由-2升高到0;
D.该反应中N元素的化合价由+4价变为+5价和+2价,所以二氧化氮既是氧化剂又是还原剂.
解答 解:A.该反应中KClO3中元素Cl的化合价由+5价降低到0价,HCl中元素Cl的化合价由-1价升高到0价,所以转移电子数为5e-,故A错误;
B.浓硫酸具有强氧化性将硫化氢氧化成S单质,本身被还原成二氧化硫,所以H2S+H2SO4(浓)═S↓+SO2↑+2H2O正确,故B正确;
C.反应2H2S+SO2═3S+2H2O中,H2S中S元素化合价由-2价升高为0价,H2S是还原剂;SO2中S元素化合价由+4价降低为0价,SO2是氧化剂,所以氧化剂与还原剂的物质的量之比是1:2,故C正确;
D.该反应中N元素的化合价由+4价变为+5价和+2价,所以生成硝酸的二氧化氮是还原剂,其计量数是2,生成NO的二氧化氮是氧化剂,其计量数是1,所以氧化剂与还原剂的物质的量比为2:1,故D错误;
故选BC.
点评 本题考查氧化还原反应,明确元素的化合价变化是解答本题的关键,并注意氧化剂、还原剂的关系来解答,难度不大.


科目:高中化学 来源: 题型:实验题
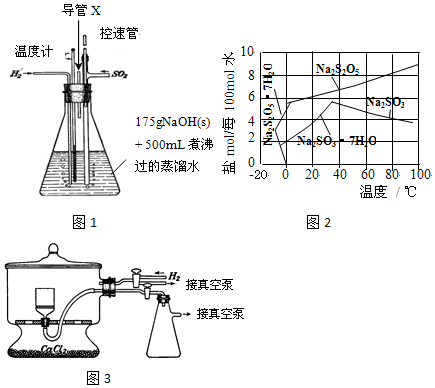
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②中水的电离程度的是①的8倍 | |
| B. | ①和③中水的电离程度相等 | |
| C. | 等体积的①和④混合后所得溶液中:c(NH3•H2O)<c(NH4+) | |
| D. | ②中水的电离程度等于④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
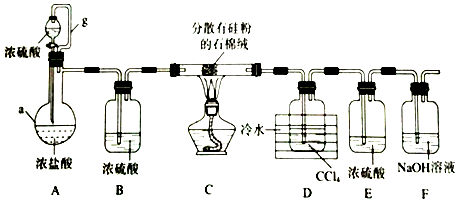
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
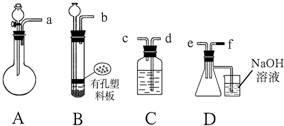
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com