
| A. | 食盐 | B. | 火碱 | C. | 草木灰 | D. | 胆矾 |
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中将氨基转化成硝基的反应为氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | 0.5 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性H2O>H2S | B. | 还原性Ⅰ->Br->Cl- | ||
| C. | 金属性 K>Na | D. | 酸性 HCl>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L乙醇分子所含的C-H键数为0.5NA | |
| B. | 3.2克O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 0.1mol•L-1的Al2(SO4)3溶液中,AL3+的数目小于0.2NA | |
| D. | 0.1molFe参加氧化还原反应,转移的电子数目一定是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
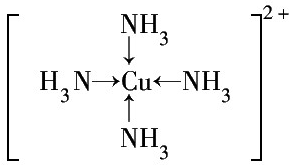 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
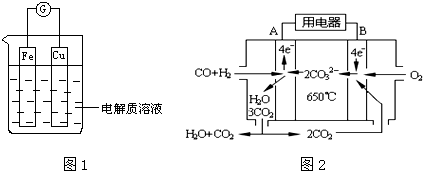
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com