
标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1 ,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( )
A.ρ=(17V+22 400)/(22.4+22.4V)
B.w=17c/(1 000ρ)
C.w=17V/(17V+22 400)
D.c=1 000Vρ/(17V+22 400)
科目:高中化学 来源: 题型:
下列关于有机化合物的认识正确的是( )
A.苯、乙醇、乙酸和酯类都可以发生取代反应
B.乙酸和乙酸乙酯互为同分异构体
C.汽油、煤油、植物油都可以燃烧,它们的主要成分也相同
D.糖类、油脂与蛋白质是基本营养物质,它们都是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温下,9 g H2O中含NA个O—H键
B.1 mol Fe2+与足量稀硝酸反应,转移3NA个电子
C.常温常压下,22.4 L SO2和O2的混合气体中含2NA个氧原子
D.0.1 mol·L-1KAl(SO4)2溶液中含0.2NA个SO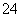
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是________(填序号,下同)。
①q=2p ②q>2p
③q<2p ④无法确定
(2)若上题中的溶质是乙醇而非硫酸,则p、q的关系是________。
①q=2p ②q>2p
③q<2p ④无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:
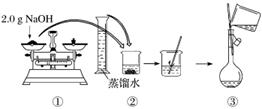
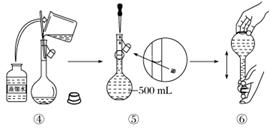
该同学的错误步骤有( )
A.1处 B.2处 C.3处 D.4处
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
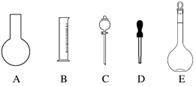
(1)如图所示的仪器中配制溶液肯定不需要的是________________________________________________________________________
(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“>”、“<”或“=”)0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电子排布式中,原子处于激发态的是( )
A.1s22s22p5
B.1s22s22p43s2
C.1s22s22p63s23p63d54s1
D.1s22s22p63s23p63d34s2
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期律是20世纪科学技术发展的重要理论依据之一。已知A、B、C、D、E五种元素都是元素周期表中前20号元素,A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水,E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族。

根据以上信息,回答下列问题:
(1)上述五种元素中电负性最大的是________。(填相关元素的元素符号)
(2)请写出D的电子排布式:____________________________。
(3)A和D的氢化物中,沸点较高的是________(填相关物质的分子式);其原因是
____________________________________。
(4)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的化学式为____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com