
 ,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)

 .
. .
.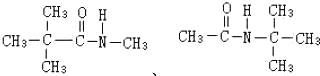 .
. 分析 结合产物的结构简式,利用流程图和起始原料的分子式知,起始原料为甲苯,所以反应①是甲苯和硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成邻硝基甲苯,根据题意知,反应②是邻硝基甲苯和高锰酸钾在加热条件下发生氧化反应生成邻硝基苯甲酸,反应③是邻硝基苯甲酸经还原反应使硝基转化为氨基,所以A的结构简式为: ,反应④是A和甲醇发生酯化反应生成
,反应④是A和甲醇发生酯化反应生成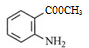 ,然后
,然后 在溴化铁作催化剂作用下,与溴发生取代反应(反应⑤),利用取代基的④定位效应知,溴原子取代氨基的邻、对位上氢原子,因此反应⑤生成物的结构简式为:
在溴化铁作催化剂作用下,与溴发生取代反应(反应⑤),利用取代基的④定位效应知,溴原子取代氨基的邻、对位上氢原子,因此反应⑤生成物的结构简式为: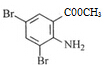 ,
,
结合流程图中B物质反应前后物质的结构简式,利用B的分子式可推知B的结构简式为: ,反应⑥中有HCl生成,而氯化氢与氨基可发生反应,可知反应⑥中加入碳酸钾的作用是中和反应生成的盐酸,同时防止盐酸和氨基发生反应,C物质的结构简式为:
,反应⑥中有HCl生成,而氯化氢与氨基可发生反应,可知反应⑥中加入碳酸钾的作用是中和反应生成的盐酸,同时防止盐酸和氨基发生反应,C物质的结构简式为: ,分子式为C6H13NO,该物质可水解的同分异构体只能含有肽键,结合只含3种化学环境下不同的氢原子,可知肽键两端连接的烷基中都只含一种氢原子,因此两个烷基只能是甲基和-C(CH3)3,由此可写出满足条件的两种同分异构体的结构简式.
,分子式为C6H13NO,该物质可水解的同分异构体只能含有肽键,结合只含3种化学环境下不同的氢原子,可知肽键两端连接的烷基中都只含一种氢原子,因此两个烷基只能是甲基和-C(CH3)3,由此可写出满足条件的两种同分异构体的结构简式.
解答 解:结合产物的结构简式,利用流程图和起始原料的分子式知,起始原料为甲苯,所以反应①是甲苯和硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成邻硝基甲苯,根据题意知,反应②是邻硝基甲苯和高锰酸钾在加热条件下发生氧化反应生成邻硝基苯甲酸,反应③是邻硝基苯甲酸经还原反应使硝基转化为氨基,所以A的结构简式为: ,反应④是A和甲醇发生酯化反应生成
,反应④是A和甲醇发生酯化反应生成 ,然后
,然后 在溴化铁作催化剂作用下,与溴发生取代反应(反应⑤),利用取代基的④定位效应知,溴原子取代氨基的邻、对位上氢原子,因此反应⑤生成物的结构简式为:
在溴化铁作催化剂作用下,与溴发生取代反应(反应⑤),利用取代基的④定位效应知,溴原子取代氨基的邻、对位上氢原子,因此反应⑤生成物的结构简式为: ,
,
结合流程图中B物质反应前后物质的结构简式,利用B的分子式可推知B的结构简式为: ,反应⑥中有HCl生成,而氯化氢与氨基可发生反应,可知反应⑥中加入碳酸钾的作用是中和反应生成的盐酸,同时防止盐酸和氨基发生反应,C物质的结构简式为:
,反应⑥中有HCl生成,而氯化氢与氨基可发生反应,可知反应⑥中加入碳酸钾的作用是中和反应生成的盐酸,同时防止盐酸和氨基发生反应,C物质的结构简式为: ,
,
(1)在浓硫酸作催化剂、水浴加热条件下,浓硝酸和甲苯发生取代反应生成邻硝基甲苯,
故答案为:HNO3、浓硫酸、水浴加热;
(2)根据上面的分析可知,反应①~⑥中属于取代反应的有①④⑤⑥,共4处.反应③的类型是还原反应,因氨基易被氧化,如果反应②③颠倒,再利用高锰酸钾、加热的条件下氧化甲基转化为羧基的同时也会将氨基氧化,所以反应②和③的顺序不能颠倒,
故答案为:4;还原反应;氨基易被氧化,利用高锰酸钾、加热的条件下氧化甲基转化为羧基的同时也会将氨基氧化;
(3)通过以上知,B的结构简式为 ,
,
故答案为: ;
;
(4)A的结构简式为: ,A在一定条件下发生缩聚反应生成高分子化合物的化学方程式为
,A在一定条件下发生缩聚反应生成高分子化合物的化学方程式为 ,
,
故答案为: ;
;
(5)反应⑥中有HCl生成,而氯化氢与氨基可发生反应,可知反应⑥中加入碳酸钾的作用是中和反应生成的盐酸,同时防止盐酸和氨基发生反应,
故答案为:生成的HCl;氨基和盐酸发生反应;
(6)C物质的结构简式为: ,分子式为C6H13NO,该物质可水解的同分异构体只能含有肽键,结合只含3种化学环境下不同的氢原子,可知肽键两端连接的烷基中都只含一种氢原子,因此两个烷基只能是甲基和-C(CH3)3,所以其同分异构体为:
,分子式为C6H13NO,该物质可水解的同分异构体只能含有肽键,结合只含3种化学环境下不同的氢原子,可知肽键两端连接的烷基中都只含一种氢原子,因此两个烷基只能是甲基和-C(CH3)3,所以其同分异构体为: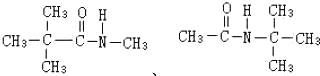 ,
,
故答案为: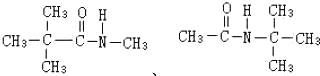 .
.
点评 本题考查了有机物的推断、结构和性质,明确有机物的官能团及其性质是解本题关键,注意结合题给信息进行分析解答,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离 | |
| B. | 可用水鉴别己烷、四氯化碳、甲酸三种无色液体 | |
| C. | 电石和饱和食盐水制乙炔的实验中,用氢氧化钠溶液除去全部气体杂质 | |
| D. | 苯和浓溴水在铁存在下制溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 合成纤维、人造纤维可统称为化学纤维 | |
| B. | 酚醛树脂和聚氯乙烯都是热固性塑料 | |
| C. | 合成纤维“六大纶”中吸湿性最好的是锦纶 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放 | |
| B. | 石英、玛瑙、太阳能电池的主要成分均为二氧化硅 | |
| C. | 海水中含有丰富的资源,不经化学反应可从海水中提取溴、镁、氯化钠等物质 | |
| D. | 直馏汽油、裂化汽油、植物油、甘油均能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.50mol•L-1 H2SO4溶液 | B. | 0.50mol•L-1 KNO3 溶液 | ||
| C. | 0.50mol•L-1酒精溶液 | D. | 0.50mol•L-1NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com