
| A. | CH3Cl | B. | CH2Cl2 | C. | CHCl3 | D. | HCl |
分析 光照条件下,CH4与足量氯气充分反应发生的反应方程式有CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl、CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl、CH2Cl2+Cl2$\stackrel{光照}{→}$CHCl3+HCl、CHCl3+Cl2$\stackrel{光照}{→}$CCl4+HCl,无论发生哪一步反应都生成HCl,据此分析解答.
解答 解:光照条件下,CH4与足量氯气充分反应发生的反应方程式有CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl、CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl、CH2Cl2+Cl2$\stackrel{光照}{→}$CHCl3+HCl、CHCl3+Cl2$\stackrel{光照}{→}$CCl4+HCl,根据方程式知,无论发生哪一步反应都生成HCl,所以反应产物的物质的量最多的是HCl,故选D.
点评 本题考查甲烷的取代反应,为高频考点,明确取代反应特点是解本题关键,注意:甲烷和氯气反应时被取代H原子与氯气分子关系式,为易错点.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合气体密度 | B. | 容器内气体的压强 | ||
| C. | 混合气体的平均相对分子质量 | D. | A的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO固体(SiO2),加过量NaOH溶液充分反应,过滤、洗涤、干燥 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水溶解、蒸发、结晶、过滤、洗涤、干燥 | |
| D. | FeCl3溶液(CuCl2),过量铁粉,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸使胆矾晶体的蓝色褪去,说明浓硫酸具有吸水性 | |
| B. | 豆科植物根部的根瘤菌可以将空气中的氮由游离态转为化合态是氮的固定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 氨水可使酚酞试剂变为红色,说明氨水显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 共价键 | N≡N | H-H | N-H |
| 键能(kJ/mol) | 946 | 436 | 390.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
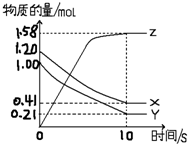 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
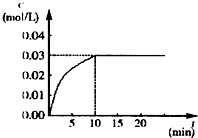 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,反应中CO2的浓度随时间变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaA的溶液呈碱性 | B. | pH=2的HA溶液稀释100倍后pH=3.5 | ||
| C. | 0.01 mol•Lˉ1HA溶液的pH=4 | D. | HA溶液跟锌反应,放出H2很慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com