
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
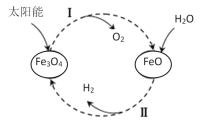
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】研究表明,![]() 可以衰变为
可以衰变为![]() ,则可用来比较这两种元素金属性强弱的方法是( )
,则可用来比较这两种元素金属性强弱的方法是( )
A.比较这两种元素的单质的熔点
B.向氯化铝和氯化镁的溶液中分别滴加过量的氨水
C.将打磨过的镁带和铝片分别与试管中的热水作用,并滴入酚酞溶液
D.将打磨过的铝片和镁带分别投入氢氧化钠溶液中,Al能与![]() 溶液反应放出氢气,而Mg不能
溶液反应放出氢气,而Mg不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F属于短周期主族元素。已知A元素原子是短周期元素原子中半径最大的原子;B元素原子是其中原子半径最小的原子;C元素原子的最外层电子数为m,次外层电子数为n;D元素原子的L层电子数为m+n,M层电子数为m-n;E元素原子的最外层电子数等于其电子层数,且在周期表中与D元素相邻;F元素原子的核外电子数是C元素原子的2倍;A、B、C三种元素可组成化合物X,C、E可组成化合物Y。
(1)D的元素符号为____,F原子的结构示意图为______,X的电子式是_______,D、C形成的是_______(填“共价”或“离子”)化合物。
(2)A~F所形成的与氖原子具有相同电子层结构的简单离子半径由大到小的顺序是______ (用离子符号表示)。
(3)化合物Y与X的水溶液反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 的原子在元素周期表中半径最小;
的原子在元素周期表中半径最小;![]() 的次外层电子数是其最外层电子数的
的次外层电子数是其最外层电子数的![]() ;
;![]() 的单质可与冷水剧烈反应,产生
的单质可与冷水剧烈反应,产生![]() 的单质;
的单质;![]() 与
与![]() 属于同一主族。下列叙述正确的是
属于同一主族。下列叙述正确的是
A.![]() 元素形成的简单离子与
元素形成的简单离子与![]() 元素形成的简单离子的核外电子总数相同
元素形成的简单离子的核外电子总数相同
B.单质的氧化性:![]()
C.化合物![]() 、
、![]() 、
、![]() 中化学键的类型完全相同
中化学键的类型完全相同
D.原子半径:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
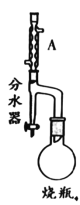
【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
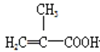 +CH3OH
+CH3OH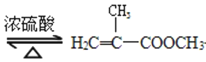 +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行的可逆反应aA(g)+bB(g)cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是( )
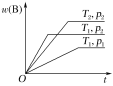
A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com