
(9分)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
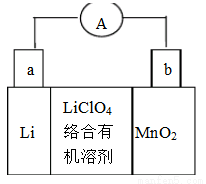
回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为____。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是____________。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
(1) b a (2) MnO2+e-+Li+=LiMnO2; (3) 否 电极Li是活泼金属,能与水反应;
(4)3MnO2+KClO3+6KOH=3K2MnO4+KCl+3H2O; 2:1.
【解析】
试题分析:(1)外电路的电流方向是由正极b流向负极a。(2)在电池正极b上发生的电极反应式为MnO2+e-+Li+=LiMnO2; (3)由于负极材料Li是活泼的金属,能够与水发生反应,所以不可用水代替电池中的混合有机溶剂。(4)根据题意结合原子守恒、电子守恒可得方程式:3MnO2+KClO3 +6KOH= 3K2MnO4+KCl+3H2O; K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2.根据化合价升降总数等于电子转移的数目可知:每转移2mol的电子,产生1mol的MnO2、2mol KMnO4。所以生成KMnO4和MnO2的物质的量之比为2:1.
考点:考查原电池电极的判断、电极反应式的书写、反应条件的选择、化学方程式的书写及氧化产物与含有产物 的物质的量的关系的计算的知识。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2013-2014北京市朝阳区高三二模理综化学试卷(解析版) 题型:简答题
(15分)
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
① 检测Fe3+是否除尽的方法是______。
② 过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因______。
③ 除去Mg2+的离子方程式是______。
④ 检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
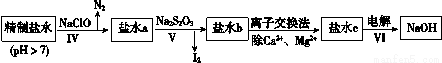
① 过程Ⅳ除去的离子是______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是______。
③ 过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:_______。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市第二学期期中测试高二化学试卷(解析版) 题型:选择题
下列符号表示的微粒,不属于官能团的是
A.—OH B.—COOH C. —NO2 D.Cl—
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:填空题
(15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液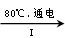 NaClO3溶液
NaClO3溶液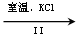 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
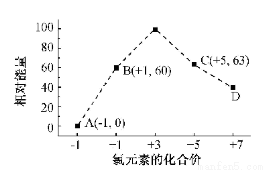
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:选择题
下列有关物质应用的说法正确的是
A.生石灰用作食品抗氧剂 B.盐类都可作调味品
C.铝罐可久盛食醋 D.小苏打是面包发酵粉的主要成分
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(海南卷解析版) 题型:选择题
室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
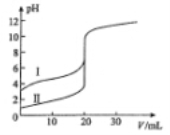
A.II表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH)= 20.00 mL时,两份溶液中c(Cl-)= C(CH3COO-)
D.V(NaOH) =10.00 mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(海南卷解析版) 题型:选择题
标准状态下,气态分子断开l mol化学键的焓变称为键焓。已知H-H、H-O和O-O键的键焓ΔH分别为436 kJ/mol、463 kJ/mol和495kJ/mol。下列热化学方程式正确的是
A.H2O (g)= H2(g)+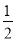 O2(g); ΔH= -485 kJ/mol
O2(g); ΔH= -485 kJ/mol
B.H2O (g)=H2(g)+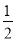 O2(g); ΔH==+485 kJ/mol
O2(g); ΔH==+485 kJ/mol
C.2H2(g)+ O2 (g)= 2H2O(g) ΔH = +485 kJ/mol
D.2H2(g)+ O 2(g)=2H2O(g) ΔH = -485 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(江苏卷解析版) 题型:填空题
(14分)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
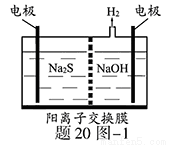
(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S (n—1)S+ S2-
S (n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
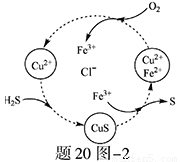
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如题20图—2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
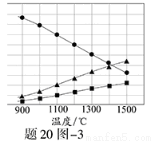
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H2S在高温下分解反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:选择题
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
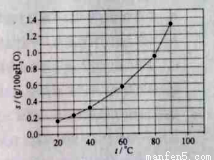
A.溴酸银的溶解时放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com