
分析 2N2(g)+6H2O(l)=4NH3(g)+3O2(g),气体物质的量增加熵增,根据盖斯定律求△H;已知:①2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-a kJ•mol-1;②2NO(g)+O2(g)═2NO2(g)△H=-b kJ•mol-1; CO的燃烧热△H=-c kJ•mol-1,即③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-ckJ/mol,根据盖斯定律计算目标反应4CO(g)+2NO2(g)=N2(g)+4CO2(g)的焓变,书写热化学方程式.
解答 解:反应2N2(g)+6H2O(l)=4NH3(g)+3O2(g)中,气体物质的量增加熵增,因为①2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-a kJ•mol-1;②2NO(g)+O2(g)═2NO2(g)△H=-b kJ•mol-1; CO的燃烧热△H=-c kJ•mol-1,即③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-ckJ/mol,根据盖斯定律可知,目标反应4CO(g)+2NO2(g)=N2(g)+4CO2(g)为①-②+2×③,所以4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=-a+b-2c kJ•mol-1.
故答案为:>;4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=-a+b-2c kJ•mol-1.
点评 本题考查了热化学方程式的书写原则和方法应用,燃烧热概念的分析判断,热化学方程式、盖斯定律的计算的计算应用,题目较简单,注意利用方程式相加减的方法处理.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 10.6g | B. | 12.6g | ||
| C. | 15.9g | D. | 数据不足,无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
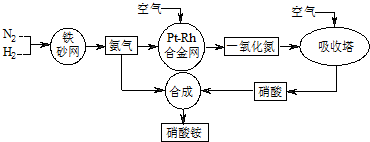
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相同,体积不同 | B. | 分子个数相同,质量相同 | ||
| C. | 体积相同,分子数不同 | D. | 体积相同,分子数也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com