
1988年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命的变化。下列说法正确的是( )
A.化学不再是纯实验化学
B.化学不再需要实验
C.化学不做实验,就什么都不知道
D.未来化学的方向还是经验化学
科目:高中化学 来源: 题型:
设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构。
②Z元素原子核内质子数比Y元素原子核内质子数少9个。
③Y和Z两种元素可以形成四核42个电子的-1价阴离子。
据此,请填空:
(1)写出X、Y、Z三种元素的名称:X________,Y________,Z________。
(2)X、Y两种元素最高价氧化物对应水化物相互反应的离子方程式为_______________________________________。
(3)用电子式表示X、Z形成化合物的过程:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答有关问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是(可多选)________。
A.CH2===CH2+HCl—→CH3CH2Cl
B.CH3CH2OH+HCl—→CH3CH2Cl+H2O
C.CH3CH3+Cl2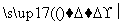 CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2===CHCl+H2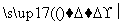 CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性高的是________反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO 和CN-等有毒有害的还原性酸根离子氧化去除。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式__________________________________,并说明该方法的优点____________________。
和CN-等有毒有害的还原性酸根离子氧化去除。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式__________________________________,并说明该方法的优点____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题:

(1)写出A、B、C、D的结构简式:
A________,B________,
C________,D________。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②____________________,反应类型________。
④____________________,反应类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某地产孔雀石的主要成分是Cu2(OH)2CO3。
(1)试写出该孔雀石高温分解的化学方程式:__________________________________________。
(2)试以(1)中所得金属氧化物为原料,分别采用湿法冶炼和高温冶炼的方式制取金属铜。供选择的试剂有:①木炭 ②铁屑 ③生石灰 ④稀H2SO4,不得另选其他试剂,写出有关反应的化学方程式。
A.湿法冶炼:________________________________________________________________________;
B.高温冶炼:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钛(Ti)是一种活泼的金属,其作为金属材料具有密度小、熔点高、可塑性强、机械强度高、亲生物性好等优良的性能。工业上常用硫酸分解钛铁矿石(FeTiO3)的方法制取二氧化钛(TiO2),再由二氧化钛制金属钛,主要有以下五个反应:
①FeTiO3+2H2SO4===TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O===H2TiO3↓+H2SO4
③H2TiO3 TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2 TiCl4+2CO
TiCl4+2CO
⑤TiCl4+2Mg===2MgCl2+Ti
(1)针对以上五个化学反应,下列叙述错误的是( )
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表明金属镁比金属钛还原性强
(2)钛具有很强的耐腐蚀性,以下对其原因的分析中正确的是________(填写代号)。
①钛是像金、铂一样不活泼的金属
②金属钛的表面易形成致密的氧化膜
③钛与氧气、酸等腐蚀剂不发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
写出具有下列分子式但仅有一个核磁共振信号的化合物的结构简式:
(1)C5H12:____________________________________________;
(2)C2H6O:___________________________________________;
(3)C2H4Br2:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二次能源”,而存在于自然界的可以提供现成形式能量的能源称为一次能源,如煤、石油、太阳能和原子能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且原料可持续利用的制氢气的方法是( )
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.以石油、天然气为原料
(2)氢气燃烧时耗氧量小,发热量大。已知下列热化学方程式:C(g)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1 H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是____________________________________________________。
(3)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.65、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com