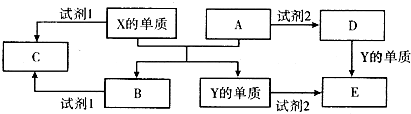
(2011?大同模拟)技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图:

(1)向沉淀池中要通入CO
2和氨气,应选通入
NH3
NH3
(填化学式).原因是
二氧化碳在水中的溶解度较小,氨气极易溶于水,所以应该先通氨气有利于吸收二氧化碳
二氧化碳在水中的溶解度较小,氨气极易溶于水,所以应该先通氨气有利于吸收二氧化碳
.
(2)沉淀池中发生的化学反应方程式是
NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓
NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓
.
(3)母液中的溶质主要是
NH4Cl
NH4Cl
.向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是
增大铵根离子浓度,使氯化铵更多析出
增大铵根离子浓度,使氯化铵更多析出
.
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了
Ⅰ
Ⅰ
(填上述流程中的编号)的循环,物质X是
CO2
CO2
从沉淀池中提取沉淀的操作是
过滤
过滤
.
(5)写出煅烧炉中发生反应的化学方程式
.
(6)这样制得的产品碳酸钠中可能含有的杂质是
NaCl
NaCl
(填化学式),为检验该杂质的存在,具体操作是
取少量试样溶解,加用硝酸酸化的硝酸银溶液,若有白色沉淀说明含有氯化钠,否则,没有氯化钠
取少量试样溶解,加用硝酸酸化的硝酸银溶液,若有白色沉淀说明含有氯化钠,否则,没有氯化钠
.




 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+