

| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.3p3表示3p能级有三个轨道 |
B.基态碳原子的价电子排布图: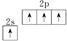 |
| C.冰和固体碘晶体中相互作用力不完全相同 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
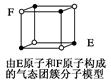
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:H2CO3<C6H5OH<H3COOH |
| B.碱性:Ba(OH)2<Ca(OH)2<KOH |
| C.熔点:MgBr2<SiCl4<BN |
| D.沸点:PH3<NH3<H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在我们常用的元素周期表中,元素被划分为两类:金属元素和非金属元素 |
| B.在元素周期表中,每个纵列的价电子层的电子总数一定相等 |
| C.在元素周期表里,主族元素所在的族序数等于原子核外电子数 |
| D.在元素周期表中,s区,d区和ds区的元素都是金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ⅣA族元素氢化物沸点顺序是GeH4 >SiH4 >CH4;则ⅤA族元素氢化物沸点顺序也是AsH3 >PH3 >NH3 |
| B.第二周期元素氢化物稳定性顺序是HF >H2O >NH3;则第三周期元素氢化物稳定性顺序也是HCl >H2S >PH3 |
| C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |
| D.干冰(CO2)是分子晶体;则二氧化硅(SiO2)也是分子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4 NH3 H2O Ar | B.OH- F- O2- Ne |
| C.H3O+ NH4+ Na+ H2F+ | D.O2- F- Mg2+ Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com