
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
分析 (1)温度越高,反应速率越快,浓度越大反应速率越快;
(2)①当分析某一因素对化学反应速率的影响时,其它物理量要相同;
②A和B、A和C的组合中不同的物理量是浓度,所以比较所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合不同点是:硫代硫酸钠和硫酸的浓度不同,所以比较所研究的问题是相同温度条件下,比较速率的不同;
(3)根据二氧化硫的溶解性强,1体积水能溶解40体积二氧化硫.
解答 解:(1)温度越高,反应速率越快,浓度越大反应速率越快,在上述实验中反应速率最快的可能是D,故选D;
(2)①能说明温度对该反应速率影响的组合中两者的温度不同,其它物理量相同,故选BD;
②A和B、A和C的组合中不同的物理量是浓度,所以比较所研究的问题是相同温度条件下浓度对该反应速率的影响,
故答案为:相同温度条件下浓度对该反应速率的影响;
③B和C的组合不同点是:硫代硫酸钠和硫酸的浓度不同,所以比较所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度,
故答案为:相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度;
(3)二氧化硫可以溶于水,1体积水能溶解40体积二氧化硫,所以导致测定不精确,且该实验装置较复杂,不易控制,所以不采用排水法测量单位时间内气体体积的大小进行比较,故答案为:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
点评 本题考查探究影响化学反应速率的因素,做对比实验时,只有改变一个条件,其它物理量相同才能得出正确结论,难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol•L-1亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5molCH5+中含有的电子数目为5NA | |
| D. | 常温下,1L0.5mol•L-1Ba(OH)2溶液中水电离的OH-个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该稀硝酸中HNO3的物质的量浓度是4.0mol/L | |
| B. | 加入NaOH溶液的体积是560mL | |
| C. | 被还原的硝酸的物质的量为0.04mol | |
| D. | 得到的金属氢氧化物的沉淀为5.81克 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离了 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
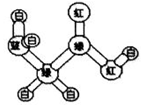 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
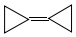 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )| A. | 一氯取代物有1种 | B. | 是环丙烷的同系物 | ||
| C. | 与环己二烯( 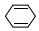 )是同分异构体 )是同分异构体 | D. | 所有的碳原子均在同一平面内 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com