
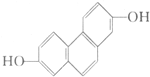
 质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物:
质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物:

科目:高中化学 来源: 题型:

| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| 太阳光 |
| 高温 |



查看答案和解析>>
科目:高中化学 来源: 题型:
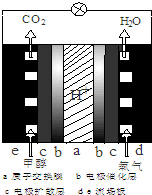 以甲醇为替代燃料是解决我国石油资源短缺的重要措施.
以甲醇为替代燃料是解决我国石油资源短缺的重要措施.查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


 (R为烃基)
(R为烃基) 反应合成聚碳酯的化学方程式
反应合成聚碳酯的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车排放的尾气和燃煤排放颗粒污染物是形成雾霾的重要因素 |
| B、为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| C、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| D、“低碳”生活倡导节能减排,禁止使用化石燃料,减少污水排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com