
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-12 mol•L-1 | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
分析 A.蒸馏水的pH=6,则c(H+)=c(OH-)=1×10-6 mol•L-1,KW=1×10-12>1×10-14,结合水的电离过程吸热分析;
B.氢离子抑制了水的电离,溶液中氢氧根离子是水电离的;
C.硫酸氢钠电离出的氢离子抑制了水的电离;
D.根据硫酸氢钠溶液中的电荷守恒、物料守恒分析.
解答 解:A.蒸馏水的pH=6,说明c(H+)=c(OH-)=1×10-6 mol•L-1,KW=1×10-12>1×10-14,说明温度高于25℃,故A正确;
B.水电离出来的氢离子的浓度等于溶液中氢氧根离子的浓度,c(H+)水=c(OH-)=$\frac{KW}{c(Η+)}$=$\frac{1×10-12}{0.01}$mol/L=1×10-10 mol•L-1,故B错误;
C.NaHSO4晶体溶于蒸馏水中能电离出氢离子,相当于一元强酸,抑制了水的电离,故C正确;
D.根据电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(SO42-),由于c(Na+)=c(SO42-),则c(H+)=c(OH-)+c(SO42-),故D正确;
故选B.
点评 本题考查了弱电解质的电离、离子浓度大小比较,题目难度中等,明确水的电离及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,是有利于提高学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1 Na2S溶液中一定有:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 向NH4Cl溶液中加入适量氨水,得到的碱性混合溶液中一定有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 加热Na2S溶液,溶液c(OH-)肯定增大,c(H+)肯定减小 | |
| D. | 加水稀释0.1mol•L-1醋酸溶液,电离平衡向右移动,c(H+)一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
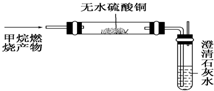 (1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染.
(1)我国西周年代写成的算卦占卜的书《周易》中,在谈到一些自然界发生的现象时说:“象曰:‘泽中有火’”试用化学方程式表示出泽中有火的化学反应CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.西气东输是我国油气管道建设史上距离最长的输气管道,总长3900公里,设计年输气量120亿立方米.这里说的气就是天然气,天然气的主要成分是甲烷(填名称),试分析使用天然气的优点清洁无污染.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100 mL量筒量取5.26 mL稀硫酸溶液 | |
| B. | 用托盘天平称取11.7 g CuO粉末 | |
| C. | 用广泛pH试纸测得溶液的pH为3.5 | |
| D. | 温度计上显示的室温读数为25.68 oC |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com