
【题目】已知: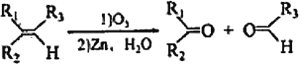 ,其中R1、R2、R3为烷基。现有一种五元环状内酯F的合成路线如下(C~G均表示一种有机化合物):
,其中R1、R2、R3为烷基。现有一种五元环状内酯F的合成路线如下(C~G均表示一种有机化合物):
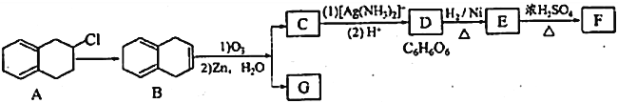
回答下列问题:
(1)化合物B的分子式为________,G中含有的官能团名称是_________________________________。
(2)由A→B所需的反应试剂和反应条件为___________________________。
(3)化合物E的系统命名为________________________________________。
(4)根据已知信息,由B生成C和G的的化学方程式为______________________________________。
(5)同时满足下列条件的G的同分异构体一共有____________________种(不含顺反异构)。
(I)与NaHCO3反应产生气体 (II)能使溴水褪色
(6)根据题给信息,写出用2,3—二甲基—2—丁烯制备丙烯的合成路线(其他试剂任选)_________。
【答案】C10H12 醛基 NaOH的醇溶液加热 消去反应 3,4—二羟基已二酸  3
3 
【解析】
根据A、B的结构简式,可知A在氢氧化钠的醇溶液中加热发生消去反应生成B;结合![]() ,可知B在相同条件下生成
,可知B在相同条件下生成![]() 和
和 ,结合D的分子式是C6H6O6,可知C是
,结合D的分子式是C6H6O6,可知C是 、G是
、G是![]() ;
;  能被银氨溶液氧化为
能被银氨溶液氧化为  ,D是
,D是 ,
, 与氢气发生加成反应生成E,E是
与氢气发生加成反应生成E,E是![]() 。
。
(1)根据化合物B的结构简式,可知B的分子式是C10H12;G是![]() ,含有的官能团名称是醛基;(2)
,含有的官能团名称是醛基;(2)![]() 在氢氧化钠的醇溶液中加热发生消去反应生成
在氢氧化钠的醇溶液中加热发生消去反应生成![]() 。 (3)化合物E是
。 (3)化合物E是![]() ,系统命名为3,4 —二羟基已二酸。 (4)根据已知信息,由
,系统命名为3,4 —二羟基已二酸。 (4)根据已知信息,由![]() 生成
生成![]() 和
和 ,的的化学方程式为
,的的化学方程式为 。 (5)与NaHCO3反应产生气体说明含有羧基,能使溴水褪色说明含有碳碳双键;同时满足条件的
。 (5)与NaHCO3反应产生气体说明含有羧基,能使溴水褪色说明含有碳碳双键;同时满足条件的![]() 的同分异构体有
的同分异构体有![]() 、
、![]() 、
、![]() ,共3种; (6) 2,3—二甲基—2—丁烯发生氧化反应,生成丙酮,丙酮再还原为2-丙醇,2-丙醇发生消去反应可生成丙烯,合成路线为
,共3种; (6) 2,3—二甲基—2—丁烯发生氧化反应,生成丙酮,丙酮再还原为2-丙醇,2-丙醇发生消去反应可生成丙烯,合成路线为 。
。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)除去下列表格物质中的杂质(括号中是杂质),从所给试剂及操作方法中选出合适的药品及方法(填序号):
除杂试剂:A.溴水 B.饱和碳酸钠溶液 C.氢氧化钠溶液 D.乙醇
操作方法:E.蒸馏 F.分液 G.洗气 H.萃取
物质(括号中是杂质) | 除杂试剂 | 操作方法 |
①硝基苯(硝酸) | _____ | _____ |
②乙酸乙酯(乙酸) | _____ | _____ |
③甲烷(乙烯) | _____ | _____ |
(2)①乙酸中官能团的名称是__________________。
②工业上用乙烯水化法制备乙醇,反应的化学方程式是______________。
③红热的铜丝插入乙醇中反复几次发生反应,反应的化学方程式是______________,该反应类型为___________反应。
④丁烷有___________种同分异构体,其中___________(写名称)熔、沸点较低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,可逆反应2NO2![]() 2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2②混合气体的压强不再改变③混合气体的平均相对分子质量不再改变④单位时间内生成n mol O2,同时生成2n mol NO⑤混合气体的颜色不再改变⑥用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1.
A. ①④⑤⑥ B. ①②③⑤ C. ②③④⑥ D. 以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用十分广泛。
(1)二价钴离子的核外电子排布式为______。基态Co原子核外3d能级上有______个未成对电子。Co与Ca属同周期,且核外最外层电子构型相同,但金属钴熔沸点都比钙高,原因是______。
(2)0.1mol[Co(NO2)6]3-中所含的σ键数目是______,K3[Co(NO2)6]中K、N、O三种元素的第一电离能由大到小的顺序是______。
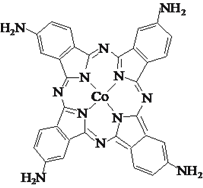
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为______。
(4)[Co(NH3)6]Cl3晶体可由CoCl2溶于氨水并通入空气制得,该配合物中配体分子的立体构型是______。
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个,该钴的化合物的化学式是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现生物体内有七十多种酶的活性与Zn2+有关,缺乏Zn2+的生物就无法正常生活,这说明无机盐
A. 对维持酸碱平衡有重要作用
B. 对维持细胞形态有重要作用
C. 对维持生物体的生命活动有重要作用
D. 对调节细胞内溶液的浓度有重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是
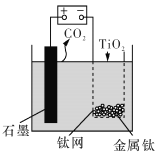
A. 电解过程中,Ca2+向阳极移动
B. 阳极的电极反应式为: C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱连接的是Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或事实与预期实验目的或所得结论对应正确的是
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含有Fe3+ |
B | 向AgNO3溶液中滴加过量氨水,溶液澄清 | Ag+与NH3H2O能大量共存 |
C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 | NH4HCO3显碱性 |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于二元酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是
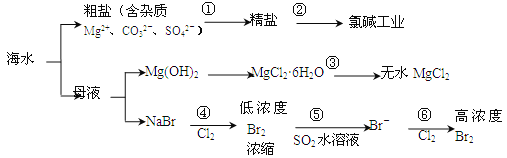
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 在过程④、⑥反应中每氧化0.2molBr-需消耗2.24LCl2
D. 过程①的提纯是物理过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积相同的3个恒温密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6KJ·mol-1
2NH3(g) ΔH=-92.6KJ·mol-1
实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | |||
N2 | H2 | NH3 | Ar | ||
① | 1 | 3 | 0 | 0 | 放出热量:Q1 |
② | 0.9 | 2.7 | 0.2 | 0 | 放出热量:Q2 |
③ | 0.9 | 2.7 | 0.2 | 0.1 | 放出热量:Q3 |
下列比较正确的是
A. 放出热量大小:Q1>Q2=Q3
B. 容器中的压强:③>①=②
C. N2的转化率:①<②<③
D. 平衡时NH3的体积分数:①=②<③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com