
【题目】草酸(H2C2O4)是一种重要的化工原料,常温下其K1=5.4×10﹣2、K2=5.4×10﹣5 . 常温下几种草酸盐溶液的pH见下表:
编号 | ① | ② | ③ |
溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
pH | 3.1 | 8.1 | 未测定 |
下列溶液中离子的物质的量浓度关系正确的是( )
A.①中:c(K+)>c(HC2O ![]() )>c(C2O
)>c(C2O ![]() )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
B.②中:c(K+)>c(C2O ![]() )>c(HC2O
)>c(HC2O ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
C.③中:c(K+)>c(HC2O ![]() )>c(C2O
)>c(C2O ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
D.③中:2c(OH﹣)+c(C2O ![]() )=3c(H2C2O4)+c(HC2O
)=3c(H2C2O4)+c(HC2O ![]() )+2c(H+)
)+2c(H+)
【答案】D
【解析】解:A.HC2O ![]() 与水都会电离出氢离子,所以溶液中c(H+)>c(C2O
与水都会电离出氢离子,所以溶液中c(H+)>c(C2O ![]() ),则溶液中离子浓度大小的关系为:c(K+)>c(HC2O
),则溶液中离子浓度大小的关系为:c(K+)>c(HC2O ![]() )>c(H+)>c(C2O
)>c(H+)>c(C2O ![]() )>c(OH﹣),故A错误; B.C2O
)>c(OH﹣),故A错误; B.C2O ![]() 水解生成HC2O
水解生成HC2O ![]() 与OH﹣ , 水电离出氢氧根离子,则c(OH﹣)>c(HC2O
与OH﹣ , 水电离出氢氧根离子,则c(OH﹣)>c(HC2O ![]() ),所以溶液中离子浓度大小的关系为:c(K+)>c(C2O
),所以溶液中离子浓度大小的关系为:c(K+)>c(C2O ![]() )>c(OH﹣)>c(HC2O
)>c(OH﹣)>c(HC2O ![]() )>c(H+),故B错误;
)>c(H+),故B错误;
C.HC2O ![]() 与C2O42﹣的混合溶液中HC2O4﹣的电离程度大于C2O
与C2O42﹣的混合溶液中HC2O4﹣的电离程度大于C2O ![]() 水解程度,溶液显酸性,则溶液中离子浓度大小的关系为:c(K+)>c(HC2O4﹣)>c(C2O
水解程度,溶液显酸性,则溶液中离子浓度大小的关系为:c(K+)>c(HC2O4﹣)>c(C2O ![]() )>c(OH﹣)>c(H+),故C错误;
)>c(OH﹣)>c(H+),故C错误;
D.0.01mol/L KHC2O4与0.01mol/L K2C2O4等体积混合,溶液中的物料守恒为:2c(K+)=3c(C2O ![]() )+3c(H2C2O4)+3c(HC2O
)+3c(H2C2O4)+3c(HC2O ![]() ),溶液中的电荷守恒为:c(K+)+c(H+)=2c(C2O
),溶液中的电荷守恒为:c(K+)+c(H+)=2c(C2O ![]() )+c(HC2O
)+c(HC2O ![]() )+c(OH﹣),联立两个关系式消去钾离子的浓度可得:2c(OH﹣)+c(C2O
)+c(OH﹣),联立两个关系式消去钾离子的浓度可得:2c(OH﹣)+c(C2O ![]() )=3c(H2C2O4)+c(HC2O
)=3c(H2C2O4)+c(HC2O ![]() )+2c(H+),故D正确.
)+2c(H+),故D正确.
故选D.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 .
A.C(s)+H2O(g)=CO(g)十H2(g)△H>O
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<O
C.2H2(g)+O2(g)=2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为: .
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为 . 通过一段时间后,向所得溶液中加入0.2molCu0粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 .
(4)0.2mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出433kJ热量,其燃烧热的热化学方程式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n].研究发现,当a=b时净水效果最好.工艺流程如下(部分操作和产物略):![]()
(1)A12O3与H2SO4发生反应的离子方程式是 .
(2)测得滤液中 ![]() >1.加入FeSO47H2O和H2O2的作用是(结合化学用语说明) .
>1.加入FeSO47H2O和H2O2的作用是(结合化学用语说明) .
(3)将溶液A电解得到液体聚合硫酸铝铁.装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)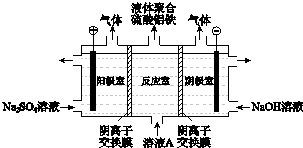
①阴极室的电极反应式是 .
②电解过程阳极室溶液pH的变化是(填“增大”、“减小”或“不变”).
③简述在反应室中生成液体聚合硫酸铝铁的原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于1molL-1硫酸溶液的说法中正确的是( )
A. 1L水中含有1mol H2SO4
B. 1L溶液中含有1mol H+
C. 1L硫酸溶液中含有96g SO42-
D. 将98g H2SO4溶于1L水中配成上述溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件已略去).已知A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65gmol﹣1 , C是空气中含量最多的单质,D是白色粉末且焰色反应呈黄色,E是一种紫红色金属,F是一种无色气体单质,H是一种红棕色气体,I是最常见的液体,K是一种强碱. 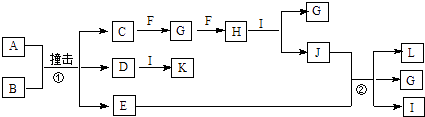
(1)F的化学式为 .
(2)K的电子式为 .
(3)写出反应①的化学方程式:
(4)写出反应②的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 标准状况下,O2的体积约为22.4 L
B. 标准状况下,CO2的气体摩尔体积为22.4 L
C. 标准状况下,0.5 mol的H2O的体积约为11.2 L
D. 0℃,101kPa时,1 mol O2和N2的混合气体的总体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素,有关信息如表:
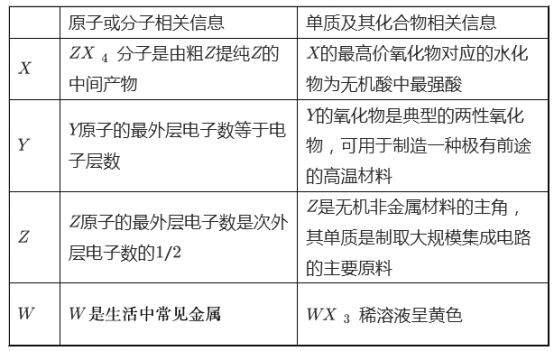
(1)W(OH)2 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程为__________。
(2)X的简单阴离子的结构示意图为______,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为______ 。
(3)ZX4分子中化学键类型______,Z的氧化物在通讯领域用来作______。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H 2 O 2 存在时可与NaOH 溶液反应生成锗酸盐,其方程式为______ 。
(4)在50 mL l mol·L -1 的YX 3 溶液中逐滴加入0.5 mol·L -1 的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积可能___ 种情况(填一或二)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,只存在+3价铁元素或氮元素的是( )
A.过量的铁丝在氯气燃烧
B.过量的铁粉与溴水反应
C.烧碱溶液吸收NO2
D.硝酸铜受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2O的离子积常数为1×10﹣14 mol2L﹣2 , 则该温度下:①0.01molL﹣1NaOH溶液的pH是多少?
②0.005molL﹣1H2SO4溶液中,水电离出的氢氧根浓度是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com