
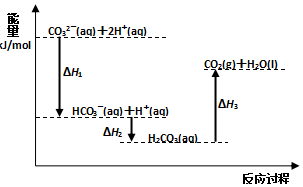
| A. | 反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应 | |
| B. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2+△H3) | |
| C. | △H1>△H2△H2<△H3 | |
| D. | H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3变小 |
分析 由图象可知,CO32-(aq)+2H+(aq)生成HCO3-(aq)+H+(aq)以及HCO3-(aq)+H+(aq)生成H2CO3(aq)都为放热反应,H2CO3(aq)生成CO2(g)+H2O(l) 为吸热反应,结合图象中能量的高低解答该题.
解答 解:A.由图象可知反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为吸热反应,故A错误;
B.由盖斯定律可知CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2+△H3),故B正确;
C.由图象可知,能量差值越大,反应热的绝对值越大,△H1、△H2都为放热反应,则△H1<△H2,故C错误;
D.加入催化剂,反应热不变,故D错误.
故选B.
点评 本题考查化学反应与能量变化,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握图象的判断,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙醚和乙醇互为同分异构体 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 聚氯乙烯可用作生产食品包装材料的原料 | |
| D. | 分子式为C3H8O的有机物,只有2种能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向装有Fe(NO3)2溶液的试符中加入稀H2SO4,在管口观察到红棕色气体,结论:HNO3分解成了NO2 | |
| B. | 高温下用焦炭还原SiO2制取粗硅 | |
| C. | Na2O2用作呼吸面具的供氧裒剂涉及氧化还原反应 | |
| D. | 浓硝酸有强氧化性,常温下能与Fe发生剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HR溶液中滴加紫色石蕊试液,溶液变红色 | |
| B. | 室温时,NaR溶液的pH大于7 | |
| C. | HR溶液加入少量NaR固体,溶解后溶液的pH变大 | |
| D. | 室温时,0.01 mol•L-1的HR溶液pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题: .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大,平衡左移 | |
| B. | 升高温度,混合气体的平均相对分子质量减小 | |
| C. | 加入Z,平衡左移,反应达到新的平衡时,体系中X的百分含量减小 | |
| D. | 反应达到平衡后再加入X,平衡右移,△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 | |
| B. | 向10mL0.05mol/LKAl(SO4)2溶液中滴加10mL0.1mol/LBa(OH)2溶液,反应后铝元素的主要存在形式是Al3+和Al(OH)3 | |
| C. | AlCl3和NaOH;HCl和NaAlO2;Na2CO3和HCl都可以不用其他试剂能鉴别出来 | |
| D. | 下列四个变化中①④可以通过一步实验直接完成①AlO2-→Al3+②Al2O3→Al(OH)3③Al3+→AlO2-④AlCl3→Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com