
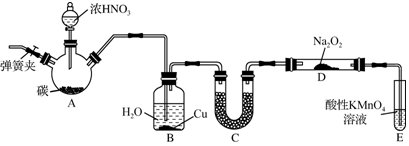
分析 制备NaNO2并对其性质作探究,由实验装置可知,A中发生C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,B中吸收挥发的硝酸和生成的二氧化氮,C中固体干燥剂干燥NO,并除去可能混有的酸雾,D中发生2NO+Na2O2═2NaNO2,E中高锰酸钾吸收尾气NO,
(1)发生反应时三颈瓶A中生成红棕色气体;
(2)B装置的目的是将NO2转化为NO、铜与稀硝酸反应生成NO;
(3)C中固体干燥剂干燥NO,并除去可能混有的酸雾,避免水蒸气和酸雾和过氧化钠反应,D中发生2NO+Na2O2═2NaNO2.
解答 解:(1)A中发生C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,生成了气体二氧化氮为红棕色气体,故答案为:生成红棕色气体;
(2)B装置的目的是,B中水吸收二氧化氮将NO2转化为NO、二氧化氮溶于水生成硝酸,铜与稀硝酸反应生成NO,
故答案为:将NO2转化为NO;铜与稀硝酸反应生成NO;
(3)C中固体干燥剂碱石灰是用来干燥NO,并除去可能混有的酸雾,故答案为:干燥NO,并除去可能混有的酸雾.
点评 本题考查了物质制备、物质性质、反应现象的理解应用,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
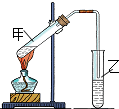
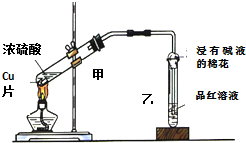 用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.
用如图装置做浓硫酸和铜反应的实验,实验过程中观察到甲试管底部有一些白色固体,乙试管中品红溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
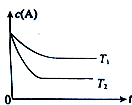
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.6 | 1.6 |
| A. | 反应在0~t1s内的平均速率v(SO2)=$\frac{0.8}{{t}_{1}}$mol•L-1•s-1 | |
| B. | 保持其他条件不变,若增大O2的浓度,到达新平衡时SO2转化率会增大 | |
| C. | 平衡时,再向容器中充入0.4mol SO2和1.6mol SO3,平衡不移动 | |
| D. | 保持温度不变,向该容器中再充入2 mol SO2、1mol O2,反应到达新平衡时$\frac{n(S{O}_{3})}{n({O}_{2})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 运用所学知识,解决下列问题:
运用所学知识,解决下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:
(1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
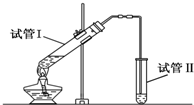 实验室用如图所示装置制备少量乙酸乙 酯.
实验室用如图所示装置制备少量乙酸乙 酯.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com