
【题目】溶于海水的CO2主要以4种无机碳形式存在,其中 HCO3-占95 % ,利用图示装置从海水中提取CO2,有利于减少环境温室气体含量。下列说法正确的是
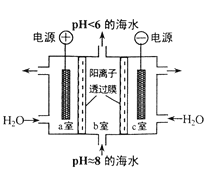
A. a 室排出的是NaOH 、Ca(OH)2等强碱性物质
B. 装置中产生的 O2和提取的 CO2的体积比约为1:4
C. c室发生的反应为 2H2O-4e-===O2↑+ 4H+
D. 电路中每有0.2mol 电子通过时,就有0.2mol阳离子从c室移至b室
【答案】B
【解析】
a室电极与电源正极相连,是电解池阳极,电极反应为2H2O4e=O2↑+4H+。H+通过阳离子交换膜进入c室;c室电极与电源负极相连,是电解池阴极,电极反应为2H2O+2e=H2↑+2OH。b室海水中阳离子通过离子交换膜进入c室,故c室排出的是NaOH、Ca(OH)2等强碱性物质。
A.根据上述分析,c 室排出的是NaOH 、Ca(OH)2等强碱性物质,故A错误;
B. 由电极反应为2H2O4e=O2↑+4H+可知,标况下产生1mol O2,同时产生4mol H+,4mol H+与4mol HCO3-反应,产生4mol CO2,相同条件下,物质的量之比等于体积之比,因此产生的 O2和提取的 CO2的体积比约为1:4,故B正确;
C. c室电极与电源负极相连,是电解池阴极,电极反应为2H2O+2e=H2↑+2OH,故C错误;
D. 电路中每有0.2mol电子通过时,就有0.2mol阳离子从a室移至b室,故D错误;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Cu(In1-xGaxSe2)(简称CIGS)可作多晶膜太阳能电池材料,具有非常好的发展前景。
回答下列问题:
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]___;Ga、In、Se,第一电离能从大到小顺序为___。
(2)硅与碳位于同主族,碳的化合物中往往有碳碳双键、碳碳三键,但是硅的化合物中只存在硅硅单键,其主要原因是___。常温常压下,SiF4呈气态,而SiCl4呈液态,其主要原因是___。
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为___。
(4)SeO32-的立体构型为___;SeO2中硒原子采取杂化类型是___。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为NA。
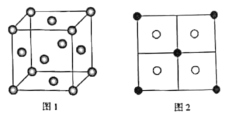
①CuS晶体中,相邻的两个铜离子间的距离为___pm。
②Cu2S晶体中,S2-的配位数为___。
③Cu2S晶体的密度为ρ=___g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。其一种生产工艺如图所示。下列说法正确的是
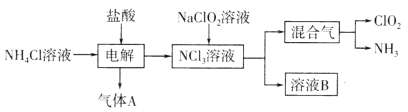
A.气体A为Cl2
B.参加反应的NaClO2和NCl3的物质的量之比为3:1
C.溶液B中含有大量的Na+、Cl-、OH-
D.可将混合气通过饱和食盐水除去C1O2中的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组推测,某无色溶液中可能含有以下离子:K+、Al3+、Mg2+、Cu2+、NH4+、Cl-、CO32-、SO42-,进行如下实验:
①取适量该溶液,加入过量NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝色的气体,并得到澄清溶液。
②在①所得溶液中通入过量CO2,生成白色沉淀。
③另取原溶液于试管中,加足量BaCl2溶液后,得白色沉淀,再加稀盐酸,沉淀不溶解。
根据上述实验回答:
(1)写出①中反应生成气体的离子方程式_______________________________。
(2)该溶液中一定存在的离子有_____________,不能确定是否存在的离子有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是被看好的一类节能新产品,下图是一种氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是
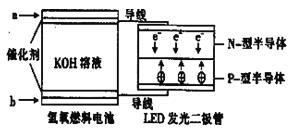
A.a处通入氢气,发生了还原反应:H2-2e-+2OH-=2H2O
B.b处通入氧气,为电池的正极
C.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替
D.P-型半导体连接的是电池负极.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于下图装置的说法正确的是

A. 若断开K1关闭K2,X、Y均为石墨,Z是NaCl溶液,则X 附近能得到氢氧化钠
B. 若断开K1关闭K2,X是纯铜,Y是粗铜,Z是CuSO4溶液,则该装置可用于铜的精炼
C. 若断开K2关闭K1,X是Cu,Y是Fe,Z是含有空气的海水,则该装置可用于保护Fe
D. 若断开K2关闭K1,X是Cu,Y是Zn,Z是稀H2SO4,则在X极有气泡生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,3.4 g NH3 的()
A.分子数约为 6.02×1023B.物质的量为 0.1 mol
C.体积约为 4.48 LD.氢原子的物质的量为 0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁储量居世界首位。用含Fe2O3的钛铁矿(主要成分为FeTiO3)制备TiO2流程如下:

已知反应TiO2++2H2O![]() H2TiO3+2H+ ΔH<0
H2TiO3+2H+ ΔH<0
(1)步骤①加Fe的目的是___________________________________(用离子方程式表达);步骤②冷却的目的是_________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是__________________;考虑成本和废物综合利用因素,废液中应加入______处理;在“水浸”步骤中加入大量的水即可获得H2TiO3沉淀,请用相关化学原理解释___________________________________________________。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的步骤为
![]() ―→
―→![]()
![]()
![]()
反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com