
| A. | 1.8×10-13 mol•L-1 | B. | 7.3×10-13 mol•L-1 | ||
| C. | 2.3 mol•L-1 | D. | 3.7 mol•L-1 |
分析 在AB2、AC均为饱和的混合液中,测得c(B-)=1.6×10-3 mol•L-1,根据Ksp(AB2)=4.2×10-8可计算c(A+),结合Ksp(AC)=3.0×10-15可计算c(C2-).
解答 解:已知Ksp(AB2)=c(A2+)×c2(B-)=4.2×10-8,c(B-)=1.6×10-3 mol•L-1,c(A+)=$\frac{4.2×1{0}^{-8}}{(1.6×1{0}^{-3})^{2}}$mol/L,
又Ksp(AC)=c(A2+)×c(C2-)=3.0×10-15.可知c(C2-)=$\frac{3.0×1{0}^{-15}}{c({A}^{2+})}$=1.8×10-13 mol/L,
故选A.
点评 本题考查了难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于学生的分析能力和计算能力的考查,注意根据Ksp计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 | |
| B. | Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和离子浓度无关 | |
| C. | 在一定温度下的BaSO4饱和溶液中加入少量BaCl2固体,BaSO4的Ksp减少 | |
| D. | 当阴、阳离子个数比相同时,难溶电解质的Ksp数值越大,溶解能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | KOH溶液的 浓度/mol•L-1 | 滴定完成时,KOH溶液滴入的体积/mL | 待测盐的体积/mL酸 |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
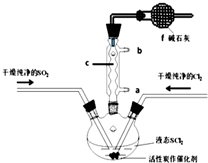 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 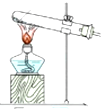 |  | 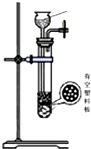 | 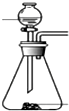 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com