
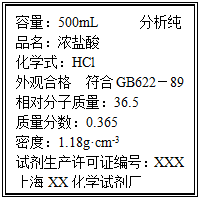
 取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.| 1000ρw |
| M |
| 106g/mol×0.100mol |
| 14.8g |
| 1000×1.18×36.6 |
| 36.5 |
| 2.50mol/L×0.1L |
| 11.8mol/L |
| 22.4L×0.125mol |
| 1mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:
硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑦⑤④⑥①②③ |
| B、⑥③⑦⑤④①② |
| C、⑥⑦⑤③④①② |
| D、⑥⑦③⑤④②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
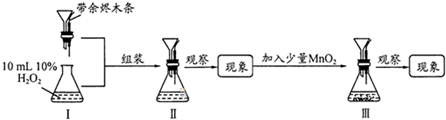
| A、实验时先加H2O2后加MnO2有利于增大固液接劁 |
| B、为使实验顺利进行,H2O2不宜从图Ⅱ漏斗处加入 |
| C、Ⅱ、Ⅲ处均可观察到迅速产生大量气泡,余烬复燃 |
| D、上述流程中不宜先加入MnO2再插入带余烬的木条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
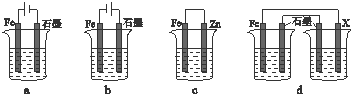
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com