
����Ŀ����ҵ�����ð�������õĸ�Ũ��NOx���壨��NO��NO2���Ʊ�NaNO2��NaNO3�������������£�
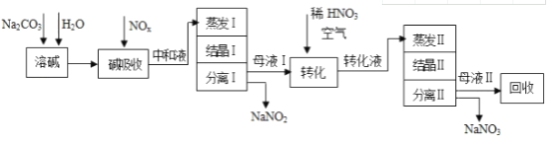
��֪��Na2CO3+NO+NO2�T2NaNO2+CO2
��1���к�Һ�������ʳ�NaNO2������Na2CO3�⣬����_________________���ѧʽ����
��2���к�Һ�������������ʱ��Ӧ����ˮ��������������Ũ�ȹ���Ŀ����_____________������������������к���������NaNO2���ж����ʣ�����ֱ���ŷţ��������������������е�_____________________����������ƣ��������
��3��ĸҺ�����ת��ʱ����ϡHNO3��Ŀ����______________________________��ĸҺ����������ã����д���������������_______��
a��ת���к�Һ b��ת��ᾧ����� c��ת��ת��Һ d��ת��ᾧ�����
��4������NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮����Ϊ2��1��������1.38��NaNO2ʱ��Na2CO3����������Ϊ______________�֣��ٶ�Na2CO3ǡ����ȫ��Ӧ����
���𰸡�NaNO3��ֹNaNO2�������ܼNaNO2ת��ΪNaNO3cd1.59
��������
���Ʊ����̿�֪��̼�����ܽ�����շ���Na2CO3+NO+NO2�T2NaNO2+CO2��3NO2+H2O=HNO3+NO��Na2CO3+2HNO3=NaNO3+H2O+CO2����Ȼ���к�Һ���������������Ӧ����Ũ�ȹ���NaNO2����������������������к���������NaNO2���ж�����Ҫ������ѭ�����ã��ᾧ���˷����NaNO3��ĸҺI����Ҫ��NaNO2��ĸҺ�����ת��ʱ����ϡHNO3�������������ṩ���Ի������ɽ�NaNO2ת��ΪNaNO3��ת��Һ�������ᾧ�����˷����NaNO3��ĸҺ������Ҫ��NaNO3��Ӧ��ת��Һ���ᾧ����������ʣ��Դ˽��1������3������4������1.38��NaNO2ʱ��n��NaNO2��=![]() =2��104mol��NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮��Ϊ2��1����n��NaNO3��=1��104mol����Naԭ���غ��֪��2n��Na2CO3��=n��NaNO2��+n��NaNO3�������m=nM������
=2��104mol��NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮��Ϊ2��1����n��NaNO3��=1��104mol����Naԭ���غ��֪��2n��Na2CO3��=n��NaNO2��+n��NaNO3�������m=nM������
���Ʊ����̿�֪��̼�����ܽ�����շ���Na2CO3+NO+NO2�T2NaNO2+CO2��3NO2+H2O=HNO3+NO��Na2CO3+2HNO3=NaNO3+H2O+CO2����Ȼ���к�Һ���������������Ӧ����Ũ�ȹ���NaNO2����������������������к���������NaNO2���ж�����Ҫ������ѭ�����ã��ᾧ���˷����NaNO3��ĸҺI����Ҫ��NaNO2��ĸҺ�����ת��ʱ����ϡHNO3�������������ṩ���Ի������ɽ�NaNO2ת��ΪNaNO3��ת��Һ�������ᾧ�����˷����NaNO3��ĸҺ������Ҫ��NaNO3��Ӧ��ת��Һ���ᾧ���������������1��������������֪�������������Һ��Ӧ����NaNO2����������NaNO3���к�Һ�к�ʣ�������Na2CO3���ʴ�Ϊ��NaNO3����2���к�Һ�������������ʱ��Ӧ����ˮ��������������Ũ�ȹ���Ŀ���Ƿ�ֹNaNO2������������������������к���������NaNO2���ж����ʣ�����ֱ���ŷţ��������������������е��ܼѭ�����ã���������ʣ���3��������������֪��ĸҺ�����ת��ʱ����ϡHNO3��Ŀ���ǽ�NaNO2ת��ΪNaNO3��ĸҺ����������ã���ת��ת��Һ��ת��ᾧ�����������������ʣ��ʴ�Ϊ����NaNO2ת��ΪNaNO3��cd����4������1.38��NaNO2ʱ��n��NaNO2��=![]() =2��104mol��NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮��Ϊ2��1����n��NaNO3��=1��104mol����Naԭ���غ��֪��2n��Na2CO3��=n��NaNO2��+n��NaNO3����m��Na2CO3��=��2��104mol+1��104mol����
=2��104mol��NaNO2��NaNO3���ֲ�Ʒ�����ʵ���֮��Ϊ2��1����n��NaNO3��=1��104mol����Naԭ���غ��֪��2n��Na2CO3��=n��NaNO2��+n��NaNO3����m��Na2CO3��=��2��104mol+1��104mol����![]() ��106g/mol=1.59��106g=1.59t��
��106g/mol=1.59��106g=1.59t��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӻ������У����������ӵĵ��Ӳ�ṹ��ͬ����(����)
A. NaCl B. LiCl
C. MgO D. Na2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ�����ɫ����Һ���ܴ����������
A.NH4����Mg2����SO42����Cl��B.Na����H����SO32����Cl��
C.Na����Cu2����SO42����OH��D.Na����Ca2����Cl����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У�������������ȷ����

A. ��AΪŨ���ᣬBΪKMnO4��C��ʢƷ����Һ����C����Һ��ɫ
B. ��AΪ���ᣬBΪCaCO3��C��ʢNa2SiO3����C����Һ�б����
C. ʵ������D������ֹ��Һ����������
D. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢAlCl3��Һ����C���Ȳ�����ɫ������������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaOH��MgCl2��AlCl3���ֹ�����ɵĻ��������������ˮ��������1.16g��ɫ������������������Һ����μ���1.00mol/L HCl��Һ������HCl��Һ����������������Ĺ�ϵ��ͼ��ʾ���Իش�
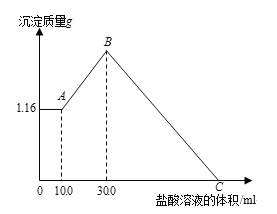
��1��д��A�㵽B�㷢����Ӧ�����ӷ���ʽ
��2��C�����������Һ�����Ϊ ��
��3��ԭ�������MgCl2�����ʵ����� ��NaOH�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. �����缫���ⱥ��ʳ��ˮ��2Cl-+2H2O![]() 2OH-+H2��+Cl2��
2OH-+H2��+Cl2��
B. ��ǿ����Һ���չ�ҵ��ȡ�����β����NO+NO2+2OH-=2NO3-+H2O
C. ������ͭ��Һ�м���NaHS��Һ���ɺ�ɫ������Cu2++HS-=CuS��+H+
D. ��Al2(SO4)3��Һ�м��������ˮ��Al3++4NH3��H2O=[Al(OH)4]-+4NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�����ӹ�ҵ�Ϸ������л���V2O5��ͨ������֪�÷Ϸ���������Ҫ�ɷ����±�:
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.2��29 | 2.8��3.1 | 22��28 | 60��65 | 1��2 | <1 |
����ͨ�����������ҵ�һ�ַϷ������Ļ��չ�������·������:

�ش���������:
��1���������ʱV2O5ת��ΪVO2+��V2O4ת��VO2+����������1������Ҫ�ɷ���_____________��
��2������������Ŀ����ʹVO2+��ΪVO2+��д���÷�Ӧ�����ӷ���ʽ________________________��
��3�����к�������֮һ��ʹ����V4O124-��ʽ��������Һ�У���������2���ijɷ���__________(�û�ѧʽ��ʾ)��
��4�������ӽ���������ϴ�����ɼ�ʾΪ:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROHΪ�����������ӽ�����֬)��������Һ����������������_______________��Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�______��(������������������������)��
R4V4O12+4OH-(ROHΪ�����������ӽ�����֬)��������Һ����������������_______________��Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó�______��(������������������������)��
��5�����������õ�ƫ�����(NH4VO3)������д���õ������Ļ�ѧ����ʽ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������״����2.24 L CO2����ͨ��1 L 0.15 mol��L��1��NaOH��Һ�У����屻������գ����й�ϵ����ȷ����(����)
A. �����Һ����ΪNaHCO3��Na2CO3
B. c(Na��)��c(H��)��c(OH��)��c(HCO3-)��2c(CO32-)
C. c(Na��)>c(CO32-)>c(HCO3-)>c(OH��)>c(H��)
D. �����������û����Һ�����յõ�Na2CO3����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com