
科目:高中化学 来源: 题型:解答题
| 化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气和氢气不再发生反应时的状态 | |
| B. | 体系中的总压强不变时的状态 | |
| C. | 氮气的浓度与氢气的浓度之比为1:3时 | |
| D. | 混合物的密度保持不变时的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 试剂X | 离子方程式 |
| A | 透明溶液中:Fe3+、SO42-、NO3- | 过量的铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| B | Cu2+、Al3+、AlO2-、Cl- | 过量的盐酸 | AlO2-+4H++=Al3++2H2O |
| C | Na+、Ba2+、HCO3-、NO3- | NaHSO4溶液 | H++HCO3--=CO2↑+H2O |
| D | pH=0的溶液中:Mg2++,Fe2++、NO3-- | 双氧水 | 2Fe2++H2O2+2H+=2Fe3++2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为283 kJ | |
| B. | 两个反应都只发生了共价键的断裂和形成 | |
| C. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1023 | |
| D. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509 kJ/mol. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能电离出H+的化合物叫做酸 | |
| B. | 摩尔是七个基本物理量之一 | |
| C. | 化合物分为酸、碱、盐和氧化物是用树状分类法分类的 | |
| D. | 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸处 |
查看答案和解析>>
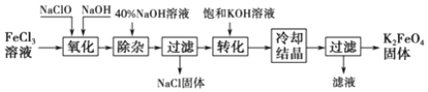
科目:高中化学 来源: 题型:推断题
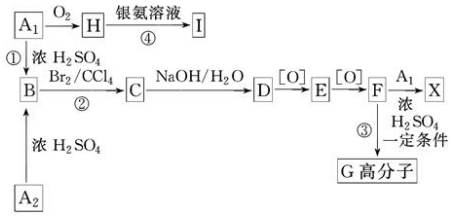
 .
. .
. .
. 、
、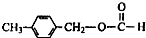
 、
、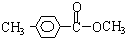 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将称量NaOH固体时在烧杯中溶解后立即转移到容量瓶中 | |
| B. | 向容量瓶中加水定容时俯视 所配溶液浓度偏高 | |
| C. | 配制NaOH溶液不需用到量筒 | |
| D. | 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com