
| A.冰、干冰、氯化钠、金刚石 | B.汞、钠、烧碱、二氧化硅 |
| C.NaCl、KCl、CsCl | D.H2O、H2S、H2Se、H2Te |
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源:不详 题型:单选题
| A.漂白粉久置于空气中会增加漂白效果 |
| B.铝制品比铁制品在空气中更容易被腐蚀 |
| C.蓝铜矿[Cu3(OH)2(CO3)2]也可表示为3CuO·2CO2·2H2O |
| D.以海水为原料能制取Na、HCl、Mg、Br2等物质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化钾溶于水时离子键未被破坏 |
| B.原子晶体中共价键越强,熔点越高 |
| C.冰融化时分子中共价键发生断裂 |
| D.范德华力越大,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种元素组成的分子中一定只有极性键 |
| B.熔融状态时能导电的化合物一定是离子晶体 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.分子晶体的熔沸点随着共价键的增强而升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
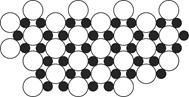
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com