
����Ŀ��ij�¶�ʱ��Ag2SO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ�����¶��£�����˵����ȷ����

A. ���д���SO42������Һ�п϶�������Ag��
B. Ag2SO4���ܶȻ�����(Ksp)Ϊ1��10��3
C. 0.02 mol��L��1��AgNO3��Һ��0.02 mol��L��1��Na2SO4��Һ�������ϲ������ɳ���
D. a���ʾAg2SO4�IJ�������Һ����������ʹ��Һ��a��䵽b��
���𰸡�C
��������
A. Ag2SO4����ˮ�г����ܽ�ƽ��Ϊ��Ag2SO4��s��![]() 2Ag+(aq)+SO42-(aq)���ܽ�Ϊ�����������Һ��һ������Ag+,��A����
2Ag+(aq)+SO42-(aq)���ܽ�Ϊ�����������Һ��һ������Ag+,��A����
B.��ͼ���֪,��c(SO42-)=5��10-2mol/Lʱ,c(Ag+)=2��10-2mol/L��Ksp= c2(Ag+)��c(SO42-)=2��10-5����B����
C. 0.02 mol��L��1��AgNO3��Һ��0.02 mol��L��1��Na2SO4��Һ��������,c(SO42-)=0.01mol/L,c(Ag+)=0.01mol/L��c2(Ag+)��c(SO42-)=1��10-6<Ksp���������ɳ���,��C��ȷ��
D.��������ʱ,��Һ�������Ӻ����������Ũ�ȶ�����,��D������
��������������ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһ�л���ѧ����]��13�֣�
�Զ��ױ���Ӣ������p-xylene����дΪPX���ǻ�ѧ��ҵ����Ҫԭ�ϡ�
��1��д��PX�Ľṹ��ʽ ��
��2��PX �ɷ����ķ�Ӧ�� �� ���Ӧ���ͣ���
��3�����ܼ���DEHP����������ͼ��ʾ��ת����ϵ������A ��PX��һ��ͬ���칹�塣
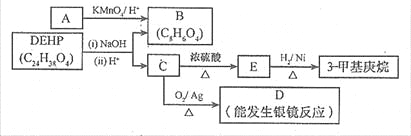
�� B �ı����ϴ���2 �ֲ�ͬ��ѧ��������ԭ�ӣ���B �Ľṹ��ʽ�� ��
�� D ���������������� �������ƣ���
�� C ������1��̼ԭ�������һ�����������DEHP�Ľṹ��ʽ��
��4��F ��B ��һ��ͬ���칹�壬��������������
a.�DZ�����λ��ȡ���b.��FeCl3��Һ��ʾ������ɫ��c.����̼��������Һ��Ӧ��
д��F ��NaHCO3��Һ��Ӧ�Ļ�ѧ����ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ַdz���Ҫ��Ԫ�أ����ĵ��ʺͻ�����Ӧ�ù㷺���ڿ�ѧ����������������Ҫ��Ӧ�á��飨As��λ�����ڱ��еĵ�4���ڣ��뵪Ԫ����ͬһ����Ԫ�أ���㷺�ֲ�����Ȼ�硣�Իش��������⣺
(1)�����̬�⻯��ĵ���ʽΪ___________�����ȶ��Ա�NH3_______������ǿ��������������
(2)NA��ʾ�����ӵ���������ֵ��46gNO2��N2O4�Ļ�������к���____NA����ԭ�ӣ���������ΪNA����NO2��CO2������庬______ NA����ԭ������1mol15N�У�����������������_______ NA����1L 1mol/LFe(NO3)3��Һ�к�_____NA��NO3�����ӡ�
(3)����������N2H4���ǵ������ֳ���������Ʊ��������ñ�ͪΪ�����������������백����Ӧ���÷�Ӧ�л�ԭ���������������ʵ���֮��Ϊ2:1��д���÷�Ӧ�Ļ�ѧ����ʽ_________________________��
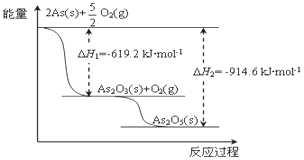
(4)��ij���������������As2O3��As2O5�������ͼ�����Ϣд��As2O5�ֽ�ΪAs2O3���Ȼ�ѧ����ʽ_______________________________________��
(5)ֱ�ӹ���ʽ����ȼ�ϵ�صĵ�ط�Ӧʽ��4NH3 + 3O2 = 2N2 + 6H2O���������Һһ��ʹ��KOH��Һ�����缫��Ӧʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ʰ�����ˮ��Һ�н���������£�H3N+CH2COOH(A+)![]() H3N+CH2COO-(A��)
H3N+CH2COO-(A��)![]() H2NCH2COO-(A-)���ı���ҺpHֵ�����ָʰ���������ӵķֲ�����(����ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ���)�仯��ͼ��ʾ����������Һ��pHֵʹ�ʰ��������ľ����Ϊ�㣬��ʱ��Һ��pH�еȵ�㡣����˵����ȷ����( )
H2NCH2COO-(A-)���ı���ҺpHֵ�����ָʰ���������ӵķֲ�����(����ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ���)�仯��ͼ��ʾ����������Һ��pHֵʹ�ʰ��������ľ����Ϊ�㣬��ʱ��Һ��pH�еȵ�㡣����˵����ȷ����( )
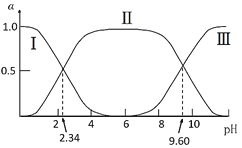
A.���ߢ�ֱ��������ΪA��A����A+
B.K2=102.34����K2��Ӧ�Ľ������Ϊ-NH3+
C.��pH=9.60����Һ�м����ᣬ��(A��)+��(A+)+��(A)���ֲ���
D.�ʰ���ĵȵ��pHԼΪ6���Ҵ���c(A��)=c(A+)=c(A)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б���ʽ��д��ȷ����( )
A.NaHCO3�ĵ��뷽��ʽ��NaHCO3=Na++H++CO32-
B.HS����ˮ�ⷽ��ʽ��HS����H2O![]() H3O����S2��
H3O����S2��
C.CO32����ˮ�ⷽ��ʽ��CO32����2H2O![]() H2CO3��2OH��
H2CO3��2OH��
D.BaSO4�ij����ܽ�ƽ�����ʽ��BaSO4(s) ![]() Ba2+(aq)��SO42��(aq)
Ba2+(aq)��SO42��(aq)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����-�����Ե��ʮ�����ã�������������������õ��IJ���Ե��ˮ�кܺõĴ����ã���˵�ع���ʱ�������������������������Ӧ�á���ѧ�ҽ���غ͵��ˮ��������Ƴ����͵ļ���ʽ��ص�������ɽ����������ת��Ϊ���ܴ��档��֪�������Ե���ܷ�Ӧ����ʽΪ��Fe+2NiOOH+2H2O![]() Fe��OH��2+2Ni��OH��2�������й�˵��������ǣ� ��
Fe��OH��2+2Ni��OH��2�������й�˵��������ǣ� ��
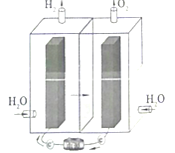
A.���ܡ��������ڶ�����Դ
B.�ô���װ���еĽ���ĤΪ�����ӽ���Ĥ
C.��װ�ô����ܷ����ķ�ӦΪ��2H2O![]() 2H2��+O2��
2H2��+O2��
D.��-�����Ե�طŵ�ʱ�����ķ�ӦΪ��Ni��OH��2+OH--e-�TNiOOH+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������������ҪӦ�ã���ѧʹ�ú���������彡�����������������ش�
��1�����Ѿ�����������SO2������ϸ����������ֹ���ѾƱ�__������������������ԭ������
��2����������ж��֣�H2Sx��x=1��2��3����������H2S2����ṹ��H2O2���ơ���д��H2S3�Ľṹʽ__��
��3��������������ڼ����ۻ�ʱ�������˽�����أ�K2S2O7������Ӧ�ж��ѵĻ�ѧ������Ϊ__��
��4������ij����С��������������ƣ�Na2S2O4������������̽������0.050ml��L-1Na2S2O4��Һ�ڿ����з��ã�����Һ��pH��ʱ�䣨t���Ĺ�ϵ��ͼ��ʾ��������Һ����ı仯����
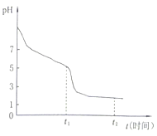
��Na2S2O4��Һ��__�ԣ�ԭ����__�������ӷ���ʽ��ʾ����
��t1ʱ��Һ��ֻ��һ�����ʣ���ʱ����Ԫ�ص�����Ũ���ɴ�С��˳��Ϊ___��
0-t1�η�����Ӧ�����ӷ���ʽΪ__��t1-t2����Һ��pH��С��ԭ����__�������ӷ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����Ƽ����Ӧ�����ӷ���ʽ����ȷ����
A.��������������ϡ���Fe��4H+��NO3-=Fe3+��NO��+2H2O
B.����ʯ��ˮ������С�մ���Һ���:Ca2++OH-+HCO3-=CaCO3��+H2O
C.�ö��Ե缫���MgCl2��Һ:2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
D.�����£��Ȼ����ҺpH<7��ԭ��NH4+��H2O=NH3��H2O��H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I��C11H12O3�����Ʊ�Һ�����ϵ��м���֮һ��������к���ȩ����������I������E��H��һ�������ºϳɣ�
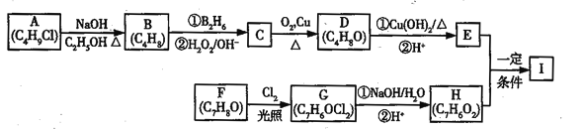
��֪������Ϣ��
��A�ĺ˴Ź������ױ�����ֻ��һ�ֻ�ѧ�������⣻
��R��CH=CH2![]() R��CH2CH2OH��
R��CH2CH2OH��
�ۻ�����F�����ϵ�һ�ȴ���ֻ�����֣�
��ͨ����ͬһ��̼ԭ�������������ǻ����ȶ�������ˮ�γ��ʻ���
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_______________________________��
��2��D�Ľṹ��ʽΪ_______________________________��
��3��E�еĹ���������Ϊ___________________________��
��4��F����G�Ļ�ѧ����ʽΪ__________________________���÷�Ӧ����Ϊ______________��
��5��I�Ľṹ��ʽΪ_________________________________��
��6��I��ͬϵ��J��I��Է�������С14��J��ͬ���칹������ͬʱ���������������ٱ�����ֻ������ȡ�������ڼ��ܷ���������Ӧ�������뱥��NaHCO3��Һ��Ӧ�ų�CO2������____�֣������������칹����J��һ��ͬ���칹�巢��������Ӧ���ữ��˴Ź�������Ϊ����壬�ҷ������Ϊ2:2:1��д��J������ͬ���칹��Ľṹ��ʽ________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com